 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Insights > Thème spécial sur l'interprétation approfondie de la qualité des produits selon les bonnes pratiques de fabrication (BPF/GMP) - Thème 1

La qualité des matériaux et des réactifs utilisés dans le processus de production des thérapies cellulaires et géniques (TCG) joue un rôle essentiel dans la détermination de la qualité finale du produit et de sa sécurité thérapeutique. Ceci est fondamental pour la protection contre la contamination exogène, qui englobe l'introduction malencontreuse de contaminants tels que bactéries, champignons, mycoplasmes et virus dans les matières premières, les substats cellulaires et les produits en production. En règle générale, les promoteurs doivent assurer un contrôle de qualité approprié des matériaux et des réactifs afin d'atténuer les risques déraisonnables pour les sujets ou les patients, par exemple en mettant en œuvre une stérilisation ou des tests de stérilité pour garantir l'absence de contaminants microbiens et viraux. Un contrôle rigoureux de la qualité des matières premières utilisées dans la production de TCG est une mesure nécessaire pour réduire le risque de contamination par des facteurs exogènes dans les produits finaux de TCG et pour garantir la sécurité et l'efficacité des produits de TCG.
Afin de garantir la sécurité des produits thérapeutiques à venir, les organismes de réglementation du monde entier ont établi des exigences pertinentes concernant la sécurité des matières premières utilisées dans la production de TCG. En particulier, la FDA recommande l'utilisation de matériaux et de réactifs facilement disponibles et réalisables, de la plus haute qualité, pour la production de TCG. Ces matériaux et réactifs sont souvent étiquetés comme étant de "qualité BPF/GMP" ou destinés à la production de thérapies cellulaires. Les principaux documents réglementaires sont les suivants
(1) Le "Content and Review of Chemistry, Manufacturing, and Controls (CMC) Information for Human Somatic Cell Therapy Investigational New Drug Applications" (Contenu et examen des informations relatives à la chimie, à la fabrication et aux contrôles) publié par la FDA en avril 2008.
(2) USP<1043> "Ancillary Materials for Cell, Gene, and Tissue-Engineered Products" (Matériaux auxiliaires pour les produits cellulaires, géniques et du génie tissulaire).
(3) EP 5.2.12 "Matières premières d'origine biologique pour la production de médicaments de thérapie cellulaire et génique".
Ces trois documents réglementaires mentionnent la sécurité des matières premières et soulignent l'importance de la sécurité.
Nos produits de qualité BPF/GMP ont été conçus et développés en tenant compte de l'ensemble des aspects liés à la sécurité, y compris le contrôle de la contamination par des facteurs exogènes tout au long du processus de production et de contrôle de la qualité. En voici les principaux aspects :
1. La lignée cellulaire utilisée pour la production est bien documentée et traçable jusqu'à la source ECACC.
2. Les cellules hôtes de production, HEK293, après avoir été domestiquées et établies, sont soumises à des tests complets (26 éléments).
Les tests sont effectués par un organisme tiers de renommée internationale, conformément aux réglementations suivantes :
• ICH Q5 Partie III : Caractérisation des lignées cellulaires : tests viraux.
• "Points to Consider in the Characterization of Cell Lines Used to Produce Biologicals" (Points à prendre en compte dans la caractérisation des lignées cellulaires utilisées pour la production de produits biologiques) (1993) de la FDA, en particulier la section "V. QUALITY CONTROL TESTING" (Tests pour le contrôle qualité).
• "Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications" (Caractérisation et qualification des substrats cellulaires et autres matériaux biologiques utilisés dans la production de vaccins viraux pour les indications de maladies infectieuses) (2010) de la FDA.
3. Les cellules modifiées font l'objet de tests supplémentaires après la construction de la banque de cellules. Les tests, effectués par un organisme tiers national réputé, portent notamment sur la stérilité, les mycoplasmes, la morphologie cellulaire, différentes méthodes d'inoculation in vitro de cellules indicatrices, la détection de rétrovirus et de virus exogènes, entre autres.
4. L'étape de culture cellulaire en amont utilise un milieu chimiquement défini (MCD) comme milieu de culture bien défini. Tous les matériaux utilisés dans le processus de production en amont sont exempts de sérum (SF) et d'ingrédients d'origine animale (AOF). La récupération et l'amplification des cellules sont effectuées dans une enceinte de sécurité biologique de classe C (BSC). L'étape de production du réacteur utilise des systèmes fermés jetables et une technologie de soudage aseptique. Les différentes étapes de la production sont séparées afin de minimiser le risque de contamination et de contamination croisée.
5. Lors de la conception du processus de purification en aval, des étapes d'élimination/inactivation des virus telles que le traitement à faible pH et la nanofiltration sont introduites. La validation du processus d'élimination virale est également effectuée (en cours) pour les étapes critiques. Le processus de purification utilise des colonnes de séparation et des milieux chromatographiques spécifiques au projet afin d'éviter les risques de contamination croisée entre les différentes étapes de production.
Les règlements suivants fournissent des indications sur la sécurité virale :
• Évaluation de la sécurité virale des produits biotechnologiques dérivés de lignées cellulaires d'origine humaine ou animale. 1999. Conférence internationale sur l'harmonisation (ICH) Q5A (R1).
• Lignes directrices sur l'évaluation de la sécurité virale des médicaments expérimentaux biotechnologiques. EMEA /CHMP / BWP / 398498 / 2005. Agence européenne des médicaments (EMA). 2009.
• Évaluation de la sécurité virale des produits biotechnologiques dérivés de lignées cellulaires humaines ou animales. Chapitres généraux de l'USP:<1050>.
6. La production de la formulation est réalisée dans un environnement de production strict de classe B+A. Après une filtration stérilisante, le produit semi-fini est traité à l'aide d'un équipement entièrement automatisé et d'un système de remplissage stérile à usage unique. Les opérations telles que l'assemblage aseptique des composants, le remplissage, le bouchage, l'alimentation et l'évacuation automatiques et la lyophilisation sont effectuées dans un environnement propre de classe B+A (contrôlé par le système de surveillance continue de l'environnement PMS). Après lyophilisation, les flacons sont scellés dans un environnement de qualité C+A. Les produits finis sont soumis à un contrôle manuel, à un étiquetage et à d'autres opérations avant d'être libérés après avoir passé le contrôle de qualité.
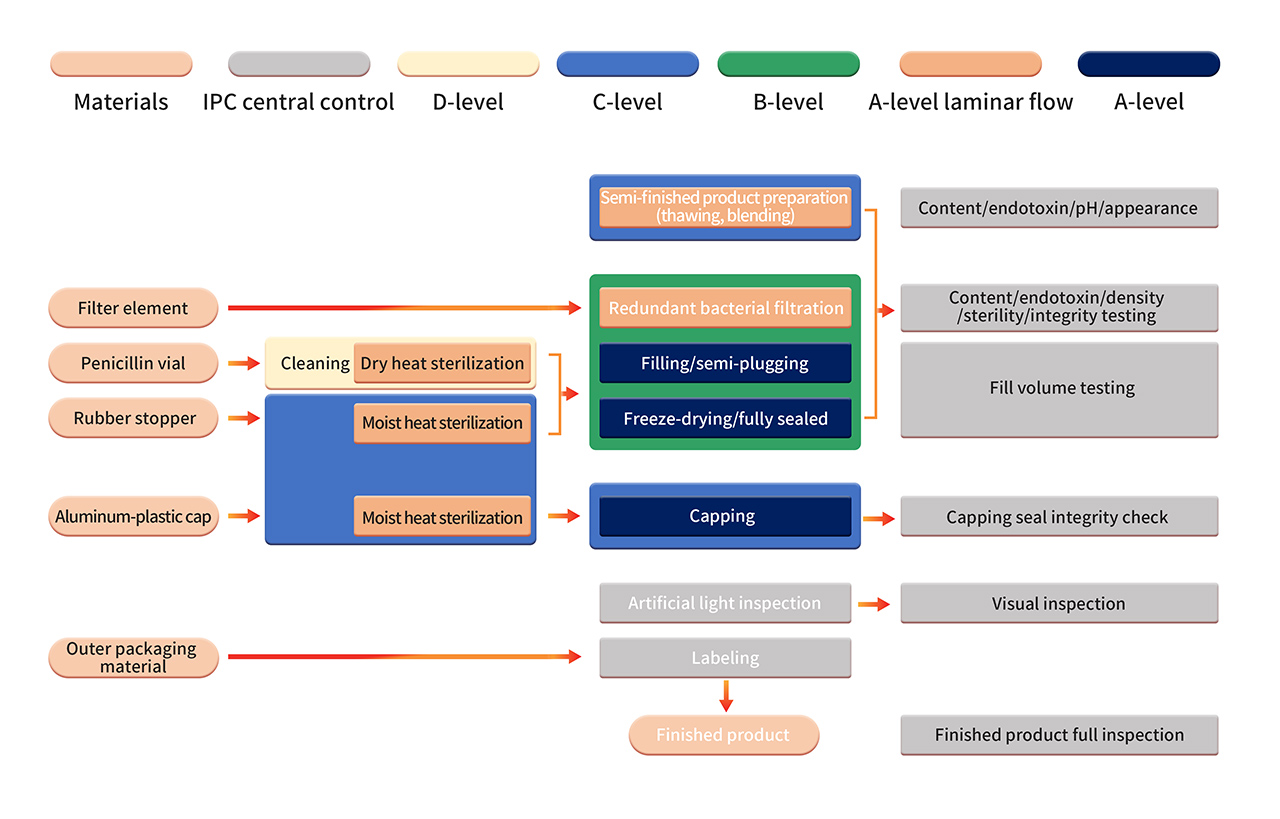
7. La validation stricte du processus aseptique comprend la confirmation régulière du contrôle du processus aseptique, y compris l'utilisation de milieux nutritifs aseptiques et/ou de substituts de produits dans des conteneurs de simulation de milieux (APS). L'APS évalue toutes les opérations aseptiques menées depuis la stérilisation et le nettoyage des matériaux de traitement jusqu'au scellement des conteneurs. Diverses opérations et interventions aseptiques connues sont examinées dans des conditions de production normales et dans le pire des cas.
Règlement de référence :
• Annexe 1 des BPF/GMP de l'UE.
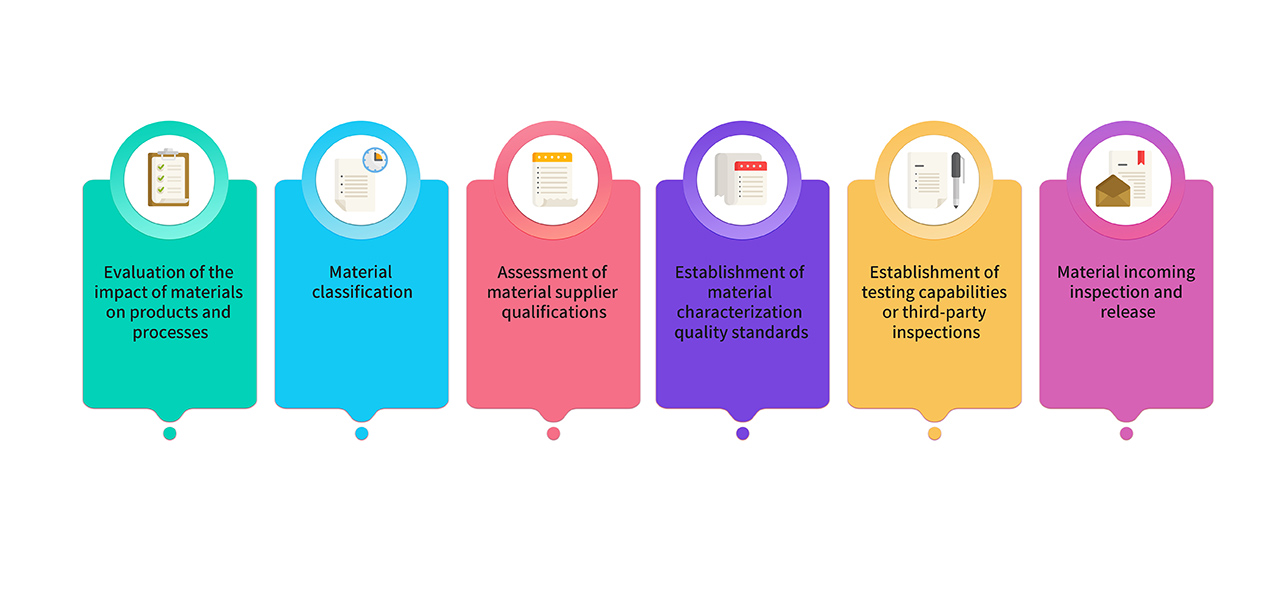
8. Les matières premières et les matériaux d'emballage utilisés pour la production sont sélectionnés à partir de matières premières de qualité pharmaceutique. Les matériaux utilisés dans la production de produits conformes aux BPF/GMP font l'objet d'une évaluation et d'une classification conjointes par les équipes de recherche, de production et de qualité. Les matériaux clés sont conformes aux exigences des réglementations et des pharmacopées pertinentes, et leurs normes de qualité sont établies par le biais d'une analyse de caractérisation critique. Le processus de gestion des matériaux est le suivant :
9. Nos produits de qualité BPF/GMP sont non seulement fabriqués dans une usine de production de qualité pharmaceutique, mais ils sont également conçus et contrôlés conformément aux réglementations nationales et internationales pertinentes des TCG. Si l'on prend l'exemple de l'IL-15 de qualité BPF/GMP, notre contrôle de qualité du produit final comprend les éléments suivants :
• SDS-PAGE >95%
• Taux d'endotoxine inférieur à 10 EU/mg
• Teneur résiduelle en ADN de la cellule hôte inférieur à 0,02ng/μg
• Teneur résiduelle en protéines de la cellule hôte inférieure à 0,5ng/μg
• Activité biologique >0,8 ×107 UI/mg (Référence IL-15 humain de l’OMS (code NIBSC: 90/530) pour norme)
• Tests microbiens
• Tests de mycoplasmes
• Tests viraux in vitro
• Cohérence d'un lot à l'autre
• Prise en charge exhaustive des données de stabilité (accélération, congélation-décongélation, long terme, vérification de la stabilité à l'expédition)
ACROBiosystems contrôle strictement les facteurs exogènes potentiels tout au long du processus de développement, de production, de test de qualité et de système de qualité, garantissant ainsi la sécurité de nos produits. Nous nous engageons à développer des réactifs de haute qualité pour une utilisation clinique en thérapie cellulaire et génique et à combiner les normes de production de médicaments avec des normes plus strictes de gestion de la qualité et de tests de libération afin de fournir aux clients des produits de qualité BPF/GMP meilleurs et plus sûrs !
La bande-annonce de notre série spéciale "Interprétation approfondie de la qualité des produits selon les BPF/GMP" est arrivée !
• Contrôle des contaminants externes dans la production de matériaux critiques pour les thérapies cellulaires et géniques.
• Stratégies de protection aseptique pour la production de matériaux critiques pour les TCG
• Système de contrôle de la qualité pour les matériaux critiques des TCG
• Système global de sécurité de la chaîne d'approvisionnement pour les matières critiques des TCG
• Comment mieux répondre aux exigences réglementaires des États-Unis pour les matériaux critiques pour les TCG
• ...


This web search service is supported by Google Inc.
