Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>































 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Protéines de la famille de l'interféron (IFN)

L'interféron (IFN) a été découvert en 1957 par Alick Isaacs et Jean Lindenmann à partir de leurs premières études sur l'interférence virale. Au fil des ans, diverses études sur l'IFN ont été réalisées, élucidant son activité antivirale. Ce n'est qu'en 1980 que l'IFN a pu être produit à grande échelle à des fins de recherche, grâce à la technologie pionnière de l'ADN recombinant. On a découvert que les protéines IFN avaient des fonctions antitumorales et immunomodulatrices, ainsi qu'une activité antivirale inhérente, ce qui les classe dans un sous-ensemble des cytokines.
La famille des protéines IFN est organisée en trois types en fonction de son récepteur correspondant : type I, type II et type III ; chacun d'entre eux est produit à des endroits différents de la cellule. L'IFN-α et l'IFN-β sont les membres les plus importants des IFN de type I et sont principalement produits par des motifs moléculaires associés à la pathogénie (PAMP). Les PAMP sont induits par la stimulation des récepteurs TLR (ressemblant à un péage) ou récepteurs cytoplasmiques de reconnaissance de motifs situés sur la membrane cellulaire. Les IFN de type II n'ont qu'un seul type, l'IFN-γ, qui est produit par diverses cellules du système immunitaire. Il s'agit de populations de cellules de type lymphoïde innées telles que les lymphocytes innés (ILC) et les cellules tueuses naturelles (NK), ainsi que de cellules immunitaires adaptatives constituées de lymphocytes T auxiliaires 1 (Th1) et de lymphocytes T cytotoxiques CD8 (CTL). Les IFN de type III sont principalement produits par les cellules épithéliales dans les cellules non hématopoïétiques, où les virus peuvent médier l'expression des interférons de type III dans différents types de cellules. Cependant, depuis la découverte de ces IFN en 2003, le mécanisme exact de leur production est encore inconnu et fait l'objet de diverses études universitaires.
Les voies de signalisation correspondantes aux trois types d'IFN sont également différentes, chacun se liant à des compositions différentes de complexes récepteurs hétérodimériques. La signalisation intracellulaire est conduite par Janus kinase/transducteur de signal et agit comme un activateur des voies de transcription (JAK/STAT).
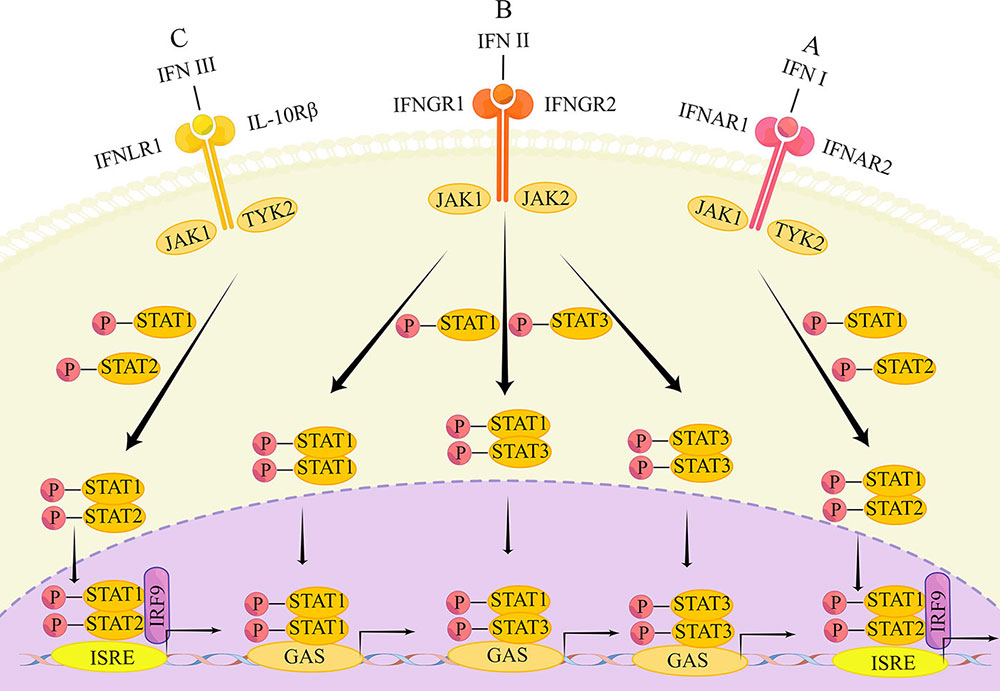
The main transduction pathways of the IFN signaling
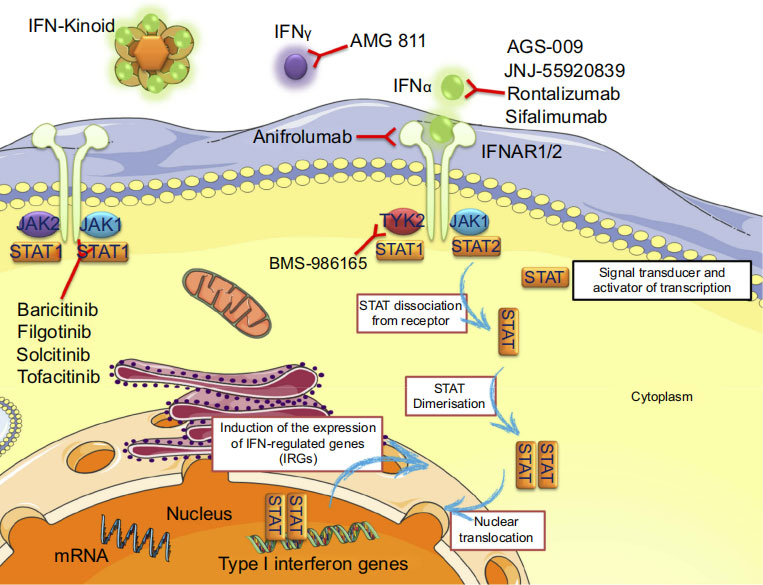
Mechanism of action of a drug targeting IFN (Anifrolumab)
En raison des effets étendus des voies de régulation de l'IFN, ce dernier est souvent associé à la progression des maladies tumorales. Des études in vitro ont montré que l'IFN peut inhiber la croissance des cellules tumorales en régulant à la hausse le cycle cellulaire et également induire l'apoptose en se liant aux ligands inducteurs d'apoptose liés au facteur de nécrose tumorale. Cependant, des études in vivo ont montré que la suppression de la voie de signalisation de l'interféron de type I ou de type II accélère la tumorigenèse et la progression.
La corrélation entre les réponses de l'IFN de type I et II et les propriétés oncogènes a mis en évidence qu'il s'agissait d'une voie importante pour la résistance ciblée aux médicaments anticancéreux. C'est ce qui a été observé à partir des cellules tumorales obtenues après un traitement anticancéreux exprimant une signalisation IFN intacte ou partiellement intacte. Il en résulte une résistance à la réplication virale, qui empêche les agents thérapeutiques ciblés d'exercer leurs effets antitumoraux normaux. Pour lutter contre ce phénomène, des thérapies ciblées inhibant la signalisation JAK/STAT par l'IFN peuvent constituer une modalité thérapeutique permettant de surmonter la résistance aux agents thérapeutiques.
Pour vous aider dans vos recherches sur la famille des protéines IFN, ACROBiosystems propose un catalogue complet d'IFN de haute qualité pour répondre à vos besoins en matière de découverte de médicaments, d'évaluation fonctionnelle et de contrôle de qualité.
![]() Expression par HEK293, conformation native des protéines
Expression par HEK293, conformation native des protéines
![]() Haute pureté vérifiée par SDS-PAGE
Haute pureté vérifiée par SDS-PAGE
![]() Grande homogénéité structurelle vérifiée par SEC-MALS
Grande homogénéité structurelle vérifiée par SEC-MALS
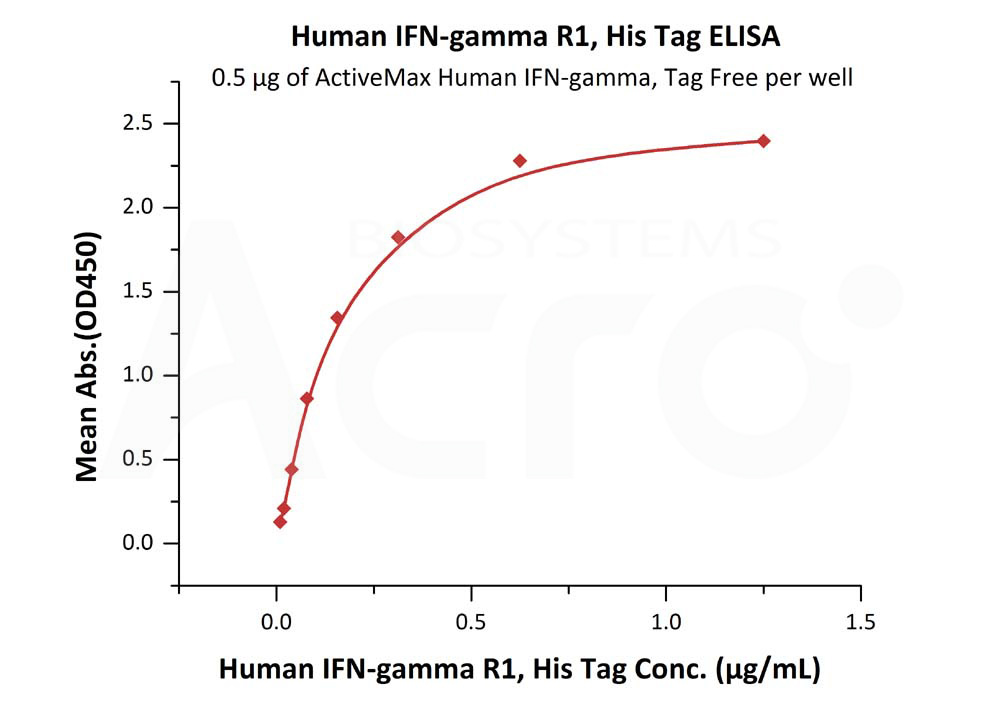
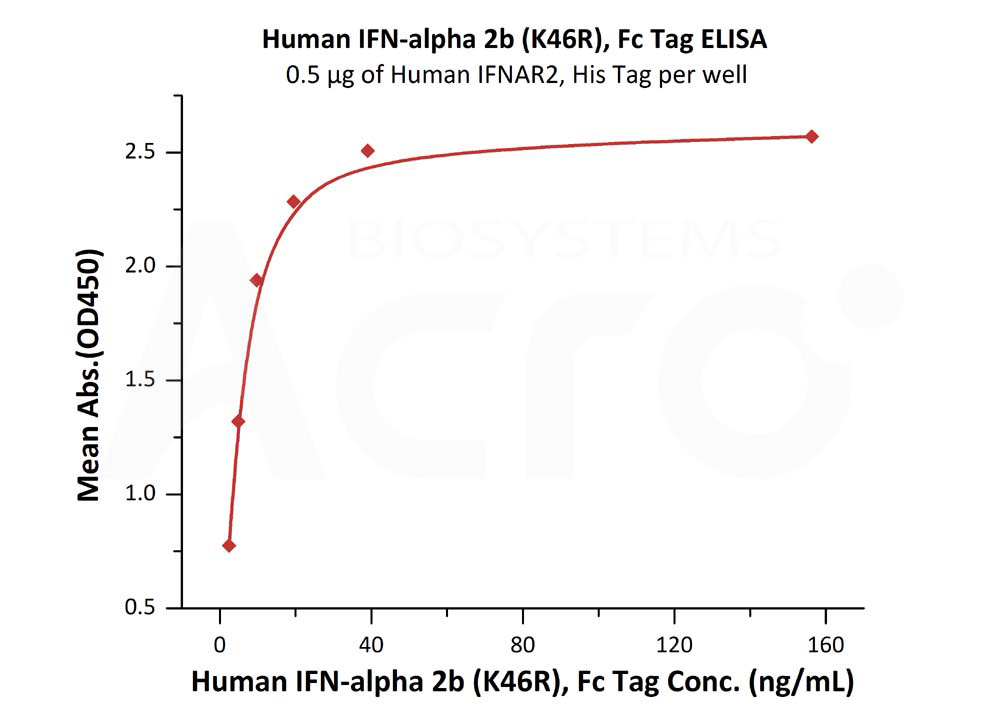
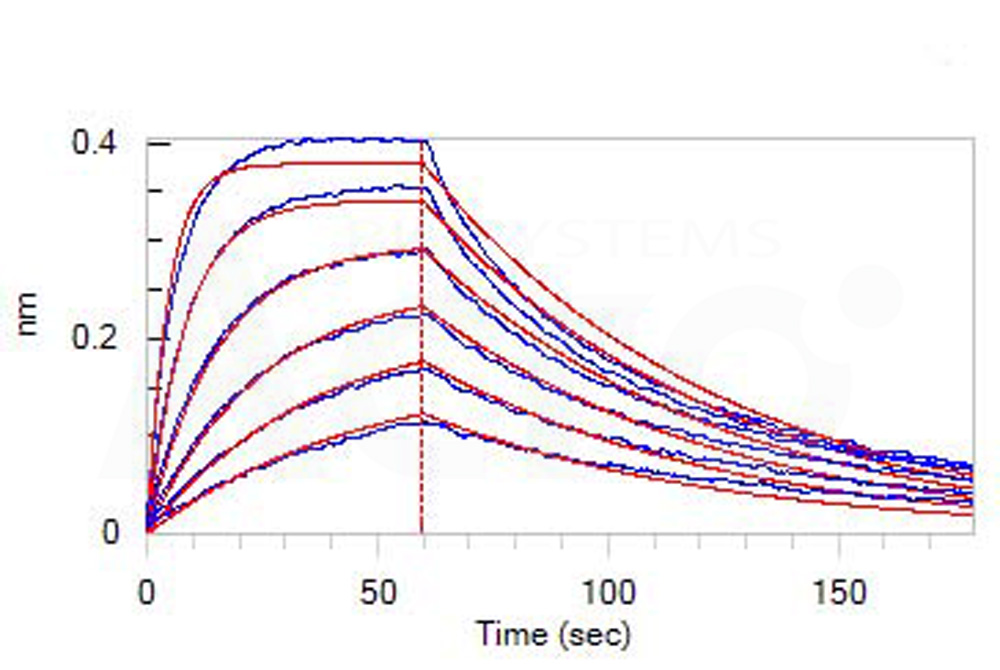
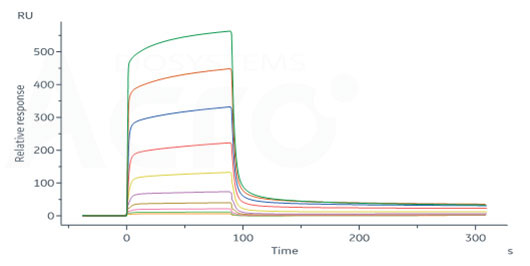
![]() Haute bioactivité vérifiée par ELISA/SPR/BLI - protocole disponible
Haute bioactivité vérifiée par ELISA/SPR/BLI - protocole disponible
![]() Haute cohérence d'un lot à l’autre
Haute cohérence d'un lot à l’autre
| Molecule | Cat. No. | Species | Product Description | Preorder/Order |
|---|
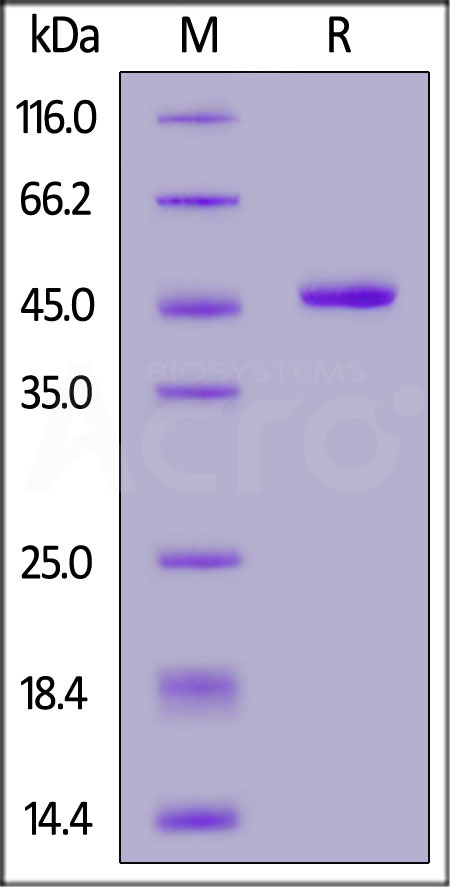
Human IFN-alpha 1 (Cat. No. IFA-H5258), Fc Tag on SDS-PAGE under reducing (R) condition. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 95%.
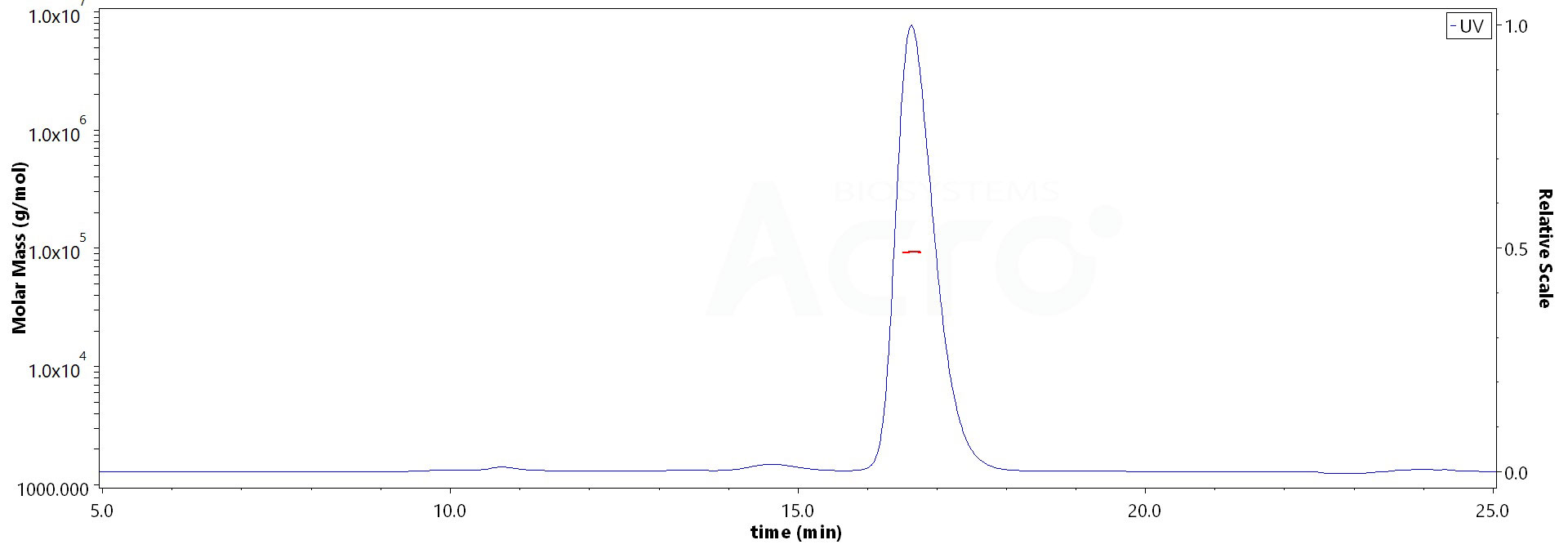
The purity of Human IFN-alpha 1, Fc Tag (Cat. No. IFA-H5258) is more than 90% and the molecular weight of this protein is around 90-118 kDa verified by SEC-MALS.
This web search service is supported by Google Inc.