Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>































 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Matières premières essentielless pour la thérapie cellulaire et génique

ACROBiosystems propose une large gamme de matières premières et d'outils nécessaires aux produits de thérapie cellulaire, notamment des cytokines, des nucléases et des billes d'activation. Nous fournissons plusieurs qualités de matériaux, y compris les qualités Premium(Pre-GMP) et GMP. Nos protéines de qualité Premium(Pre-GMP) proviennent du même clone, de la même séquence et du même système d'expression que nos produits GMP. Cela signifie que les développeurs qui utilisent nos produits de qualité Premium(Pre-GMP) peuvent facilement passer à des produits GMP pour une utilisation dans les étapes CMC ou cliniques sans avoir à réaliser davantage d'études de comparabilité du processus de fabrication.
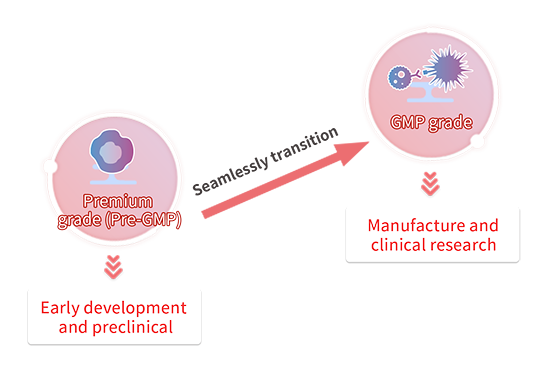
Pour faciliter la transition de votre produit de thérapie cellulaire vers les essais cliniques et au-delà, il est essentiel de développer une stratégie de matières premières qui tienne compte de l'objectif final. Le plus souvent, pour les premiers stades de la recherche et du développement de thérapie cellulaire, des matériaux à usage exclusif de recherche (RUO) sont utilisés. Toutefois, à mesure que le développement progresse vers les phases précliniques ou cliniques, les matériaux RUO qui ont pu suffire en amont ne répondent plus aux critères requis pour poursuivre. La plupart des stratégies mettent l'accent sur l'utilisation des meilleures qualités de matières premières disponibles le plus tôt possible; toutefois, cela n'est pas toujours possible. La prise en compte des transitions entre les catégories de matériaux peut aider à équilibrer à la fois les performances et les coûts lors du passage à l'étape suivante.
ACROBiosystems propose plusieurs qualités de matériaux pour les différentes étapes de développement de votre produit de thérapie cellulaire. Les matériaux de qualité supérieure sont produits dans le cadre de notre système rigoureux de contrôle de la qualité qui comprend un ensemble complet de tests, notamment des tests de stérilité et d'endotoxines. Les performances des produits sont soigneusement validées et testées pour vérifier leur compatibilité avec les cultures cellulaires ou toute autre application au stade préclinique précoce. Lorsque vous êtes prêt à passer aux phases cliniques ultérieures, nous proposons également un service de protéines GMP personnalisé qui s'adapte à vos besoins. Les matériaux de qualité GMP sont développés à l'aide de notre plateforme de système de gestion de la qualité de qualité GMP. Ces produits sont fabriqués selon des normes strictes de gestion de la qualité et de test de niveau pour la délivrance de médicaments. Étant donné que nos composants de qualité Premium(Pre-GMP) sont similaires à nos produits GMP, le passage d'une qualité à l'autre peut être facilement effectué sans autres études de comparabilité.
| Premium(Pre-GMP) Grade | GMP Grade | |
|---|---|---|
| Application | Research and Development; Preclinical research, seamless transition into clinical phases | Designed to meet clinical phase requirements and bolster your IND application to various regulatory bodies. |
| Quality System | ISO 9001 /ISO 13485 Certified | ISO 9001 /ISO 13485 Certified (Development stage) GMP Quality Management System (Production stage) |
| Production | ISO certified facilities | GMP certified facilities -by third-party audits |
| Transient or stable cell lines | Stable cell lines (Comprehensive external inspections) | |
| Animal-origin free materials or BSE/TSE free | Animal-origin free materials or BSE/TSE free | |
| Pharmaceutical-grade materials | Pharmaceutical-grade materials | |
| Strict 2 grade series sterile filtration | Strict 2 grade series sterile filtration | |
| Class 100 FFU | Class B+A cleanroom with automatic filling machine | |
| No additional virus clearance steps in | 2 additional virus removal and inactivation steps included (nanofiltration + low pH) | |
| Quality Control | Sterility / Mycoplasma testing | Sterility / Mycoplasma testing |
| Endotoxin control and detection | Endotoxin control and detection | |
| Validated key equipment and analytical instruments | Validated equipment /analytical instruments/analytical methods(analytical instruments audit trial) | |
| Residual DNA/HCP testing | Residual DNA/HCP testing | |
| Limited adventitious agent testing | Full adventitious agent testing (virus testing and animal in vivo safety experiments) | |
| Documentation | Common regulatory support | Comprehensive regulatory support files |
| DMF filing (Few products) | DMF filing (All products) |
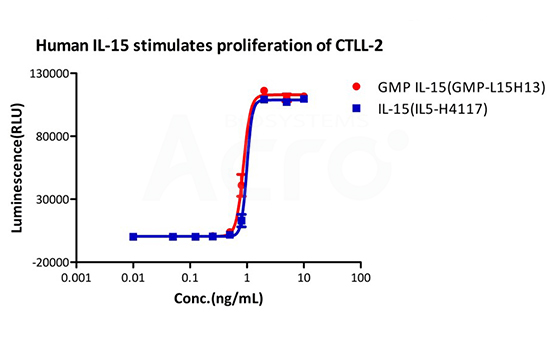
Recombinant Human IL-15 Protein premium grade (IL5-H4117), designed for preclinical stage, has the same activity and performance with GMP Grade IL-15 (GMP-L15H13), which enables a seamless transition from preclinical development to clinical phases .
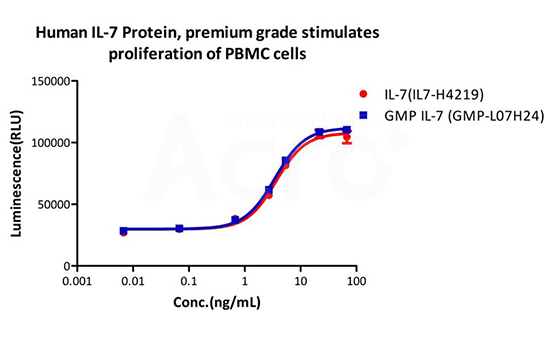
Human IL-7 Protein premium grade (IL7-H4219) designed for preclinical stage, has the same activity and performance with GMP Grade IL-7 (GMP-L07H24), which enables a seamless transition from preclinical development to clinical phases .
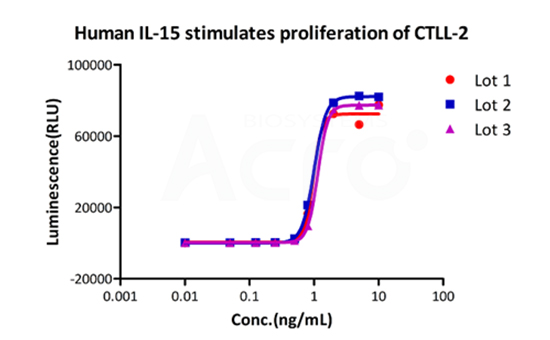
Bioactivity of three different lots of GMP Human IL-15 (GMP-L15H13) verified by cell-based assay, and the result shows very high batch-to-batch consistency.
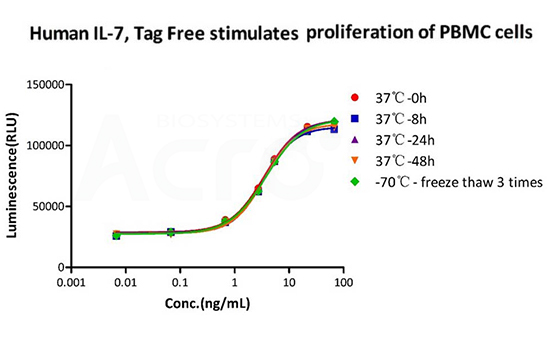
The Cell based assay shows that GMP Human IL-7 (GMP-L07H24) is stable at 37°C for 48 hours and after freezing and thawing 3 times.
This web search service is supported by Google Inc.











