Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>































 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Fibrilles préformées (PFF)--Une nouvelle approche de la modélisation de la neurodégénération
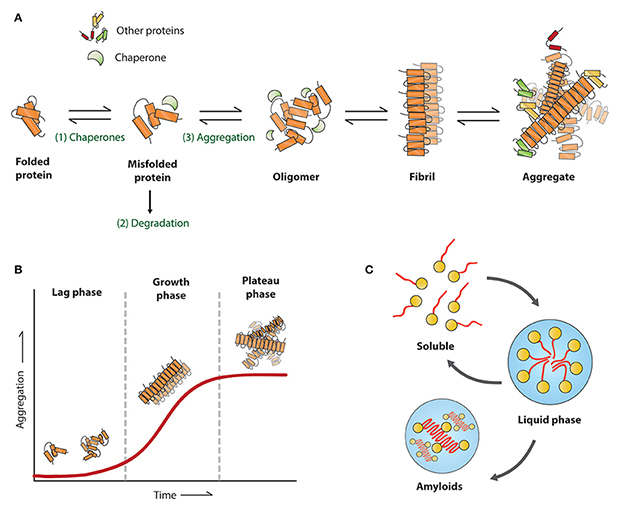
L'agrégation des protéines est une caractéristique pathologique majeure des maladies neurodégénératives telles que la maladie d'Alzheimer (AD), la maladie de Parkinson (PD), la sclérose latérale amyotrophique (ALS) et la maladie de Huntington (HD). Dans des conditions pathologiques, les protéines Tau, Amyloïde bêta, alpha-synucléine, TDP-43, Huntingtin et autres s'intègrent dans un large éventail de structures indésirables, qui vont des oligomères et assemblages préfibrillaires aux agrégats hautement ordonnés. La structure fibrillaire représente une phase de croissance rapide de l'agrégation des protéines car ces fibrilles sont "actives" et recrutent rapidement des monomères pour leur élongation. En outre, ces fibrilles se brisent de manière aléatoire en fragments plus courts qui pourraient agir comme des "graines", qui se transmettent à d'autres cellules et recrutent indépendamment des monomères pour former de nouvelles fibrilles. Les fibrilles préformées (PFF) sont des fibrilles actives formées in vitro qui ont cette activité " d'ensemencement " et sont capables de recruter continuellement des protéines pathologiques endogènes solubles pour former des agrégats et finalement induire des pathologies neurodégénératives.
L'établissement de modèles de maladie fiables est crucial pour découvrir les mécanismes pathologiques, évaluer l'efficacité des interventions thérapeutiques et la sécurité des candidats médicaments. Par rapport aux approches traditionnelles de modélisation des maladies, la pathologie induite par les PFF ne dépend pas de la modification des gènes, ni de dommages chimiques ou physiques, et elle peut mieux imiter les processus des états pathologiques naturels. Par conséquent, les PFF constituent une nouvelle approche pour la modélisation des maladies neurodégénératives.
Les PFF ont pu être générées à partir de monomères soit par incubation à 37°C et agitation, soit par induction à l'héparine. Le contrôle de la qualité et une préparation initiale précise sont importants pour la réussite des expériences. Un aspect important de l'induction réussie de PFF est l'utilisation d'un monomère de haute qualité, de grande pureté, de concentration élevée et de conformation correcte. Par ailleurs, étant donné que l'application des PFF est l'expérimentation cellulaire et animale, le contrôle de l'endotoxine est également un facteur important. En outre, avant l'utilisation des PFF, les PFF doivent atteindre une longueur de 50 nm ou moins par ultrasons afin de garantir leur activité de recrutement et de faciliter leur endocytose.
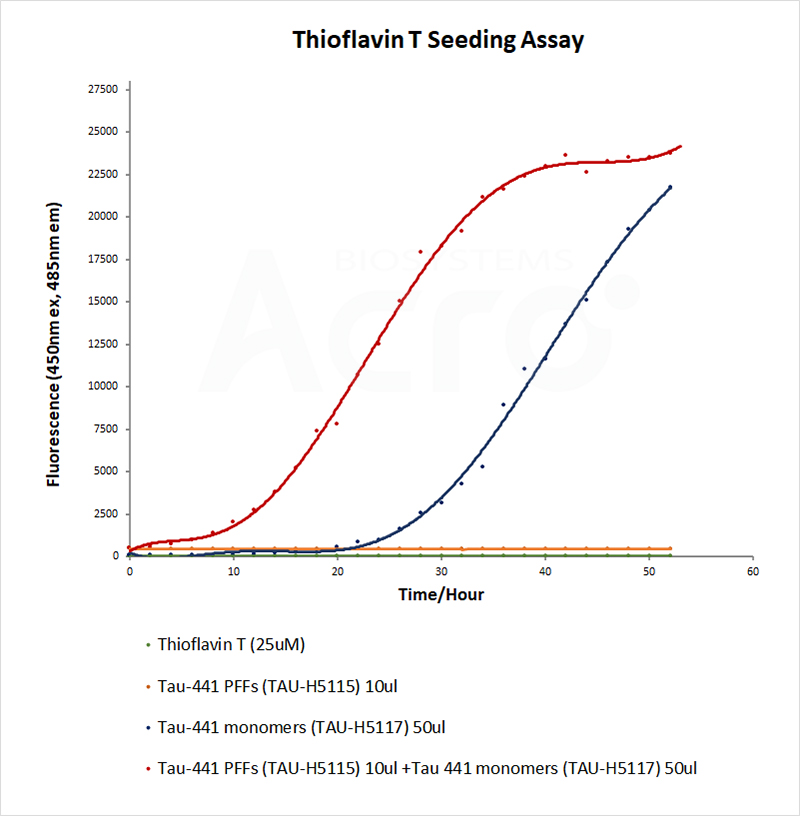
La morphologie et l'activité des PFF ont pu être vérifiées respectivement par microscope électronique et par test de fluorescence à la thioflavine T (ThT). Les PFFs induites avec succès montrent une structure fibrillaire au microscope électronique. Le test ThT est un test classique pour détecter les structures β-sheet. Les PFF acquièrent de plus en plus de structures β-sheet au fur et à mesure qu'ils recrutent des monomères, et lorsque le ThT se lie à la structure β-sheet, la valeur de fluorescence augmente, reflétant ainsi l'activité des PFF.
Aneuro est la marque d'ACROBiosystems qui se concentre sur le domaine des neurosciences. Aneuro fournit des PFF de Tau-441, des PFF d'alpha-synucléine, des PFF d'amyloïde bêta, des PFF de TDP-43 et des PFF de SOD-1, soutenant et accélérant l'établissement de modèles neurodégénératifs fiables.
| Molecule | Cat. No. | Product Description | Monomer Source | Expression System | Preorder/Order |
|---|---|---|---|---|---|
| Tau | TAU-H5115 | Human Tau-441/2N4R Pre-formed Fibrils Protein, Tag Free | TAU-H5117 | E.coli | |
| TAU-H5116 | Human Tau-441 K18 Pre-formed Fibrils Protein, Tag Free | NA | E.coli | ||
| TAU-H5113 | Human Tau-441 K18 (P301L) Pre-formed Fibrils Protein, Tag Free | TAU-H5118 | E.coli | ||
| Alpha-Synuclein | ALN-H5114 | Human Alpha-Synuclein (A53T) Pre-formed Fibrils Protein, Tag Free | ALN-H5116 | E.coli | |
| ALN-H5115 | Human Alpha-Synuclein Pre-formed Fibrils Protein, Tag Free | ALN-H5214 | E.coli |
Meanwhile, alpha-synuclein PFFs,Amyloid beta PFFs,TDP-43 PFFs,SOD-1 PFFs are under development. Laissez un message
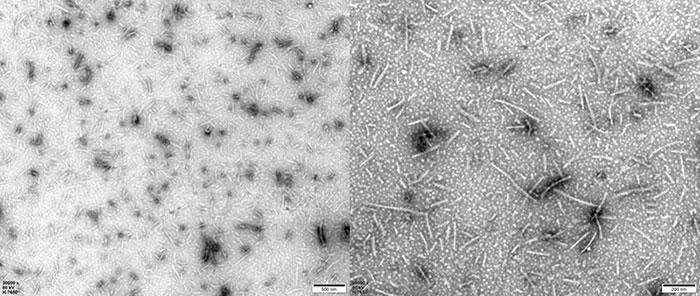
TEM of Human Tau-441/2N4R Pre-formed Fibrils Protein (Cat. No. TAU-H5115).
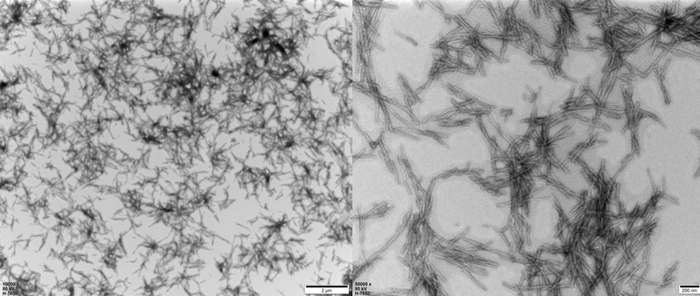
TEM of Human Tau-441 K18 (P301L) Pre-formed Fibrils Protein (Cat. No. TAU-H5113).
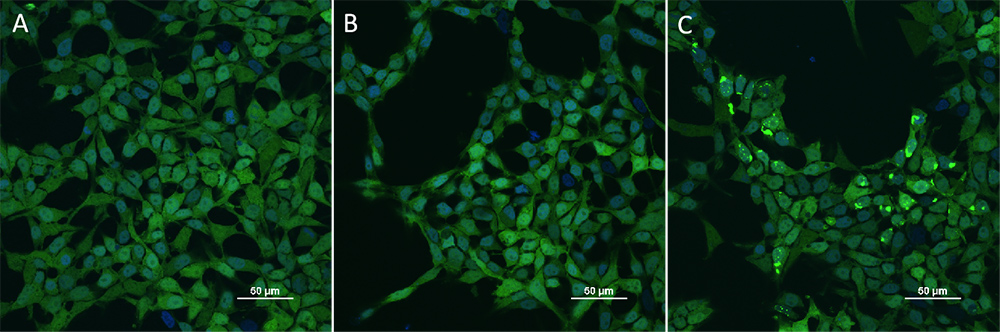
HEK293/Human Tau(GFP) Stable Cell Line were transduced with Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) (Cat. No. TAU-H5115) and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) (Cat. No. TAU-H5117) respectively. The fluorescence of GFP-Tau (Green) and DAPI (Blue) were detected by confocal microscope. A. Lipo2000 transduction. B. Lipo2000 and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) transduction. C. Lipo2000 and Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) transduction. Scale bars, 50 μm.
1. Stroo E, Koopman M, Nollen EA, Mata-Cabana A. Cellular Regulation of Amyloid Formation in Aging and Disease. Front Neurosci (2017). doi: 10.3389/fnins.2017.00064. PMID: 28261044; PMCID: PMC5306383.
2. Guo JL, Lee VM. Seeding of normal Tau by pathological Tau conformers drives pathogenesis of Alzheimer-like tangles. J Biol Chem (2011). doi: 10.1074/jbc.M110.209296. Epub 2011 Mar 3. PMID: 21372138; PMCID: PMC3083182.
This web search service is supported by Google Inc.