 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Insights > Thème spécial sur l'interprétation approfondie de la qualité des produits selon les bonnes pratiques de fabrication (BPF/GMP) - Thème 2 
Compte tenu de la nature aseptique de la production de produits de thérapie cellulaire, il est impératif que les matières premières utilisées dans le processus soient stériles. L'incapacité à garantir la stérilité représente un revers critique dans la fabrication de produits de thérapie cellulaire, entraînant l'impossibilité de fournir aux patients des médicaments répondant aux exigences de qualité dans les délais impartis.
La stérilité est donc un attribut de qualité essentiel pour les matières premières dans le contexte de la thérapie cellulaire. La stratégie de contrôle aseptique employée au cours du processus de production des matières premières revêt une importance accrue, en particulier pour les processus de production de cytokines, d'anticorps et d'enzymes. Ces procédés impliquent souvent des processus de stérilisation non terminale. Il est essentiel de procéder à une évaluation approfondie des risques afin d'identifier les sources potentielles de contamination microbienne. L'évaluation doit comprendre un examen complet de divers facteurs, y compris, mais sans s'y limiter, l'installation, l'équipement, la conception du processus, la manutention des matériaux, les besoins en personnel, les opérations de production et la surveillance de l'environnement. Par la suite, il est essentiel de formuler des mesures de contrôle ciblées afin d'améliorer la gestion de la production et le contrôle de la qualité.
Dans ce contexte, les stratégies de contrôle aseptique sont soumises à des normes strictes définies par diverses réglementations et lignes directrices relatives aux bonnes pratiques de fabrication (BPF/GMP) dans différents pays. L'industrie adhère systématiquement à un ensemble de réglementations et de directives BPF/GMP communément reconnues, qui englobent les éléments suivants
1. Annexe 1 des bonnes pratiques de fabrication de l'Union européenne (BPF/GMP de l'UE) : Fabrication de médicaments stériles
2. Bonnes pratiques de fabrication actuelles de la FDA des États-Unis (21 CFR Part 210, 211, 600)
3. FDA Guidance for Industry : Produits pharmaceutiques stériles obtenus par traitement aseptique
4. PIC/S BPF/GMP Annexe 1 : Fabrication de médicaments stériles
Parmi celles-ci, la nouvelle version de l'annexe 1 des BPF/GMP de l'UE, qui a été introduite le 25 août 2023, contient les exigences les plus strictes pour la production de produits stériles. Le règlement couvre spécifiquement les ingrédients pharmaceutiques actifs, les excipients, les matériaux d'emballage principaux, les formes de dosage finies, ainsi que les différentes tailles d'emballage, les processus de production et les technologies. Par ailleurs, le règlement fournit des directives générales sur la conception et le contrôle des installations, des équipements, des systèmes et des procédures utilisés pour la production de tous les produits stériles, conformément aux principes de la gestion des risques à la qualité (QRM). L'objectif est de garantir l'absence de micro-organismes, de particules et de contamination endotoxinique/azotée dans le produit final. Les orientations mettent l'accent sur l'évaluation globale et le contrôle de la contamination à partir d'aspects tels que l'installation, l'équipement, le processus, les matériaux, les tests et la surveillance de l'environnement.
ACROBiosystems veille à ce que ses produits de thérapie cellulaire de qualité BPF/GMP soient conformes aux normes réglementaires et d'orientation susmentionnées. Grâce à une approche intégrée, l'entreprise conçoit et incorpore méticuleusement des stratégies de contrôle aseptique pour les installations, les équipements, les matériaux, les processus et le personnel. Le perfectionnement et l'amélioration en continu font partie intégrante de l'engagement d'ACROBiosystems en matière d'assurance qualité, facilité par l'application systématique des outils PDCA (Plan-Do-Check-Act, Planifier-Faire-Vérifier-Agir)
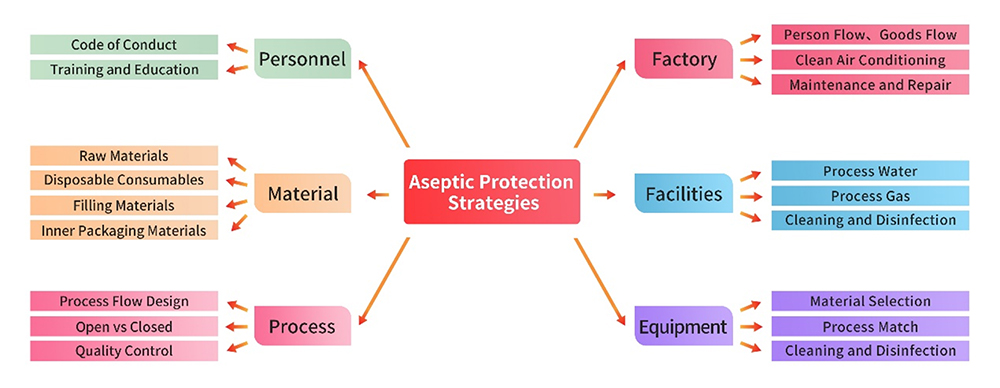
1. Installations et équipements
Les installations de production, les services publics et les équipements sont conformes à des règles strictes en matière de BPF/GMP. Avant de lancer la production d'un produit, une analyse complète des lacunes et une évaluation des risques sont effectuées pour chaque installation et chaque équipement. Des procédures écrites sont élaborées et strictement appliquées, couvrant des domaines tels que l'utilisation, le nettoyage, la désinfection et l'entretien. Ces mesures garantissent que la gestion de ces infrastructures est exécutée avec précision, évitant ainsi tout impact négatif sur le contrôle aseptique.
2. Gestion du personnel
Le personnel engagé dans les activités de production et de gestion de la qualité possède le bagage éducatif, la formation et l'expérience nécessaires pour maintenir les normes de production et contrôler efficacement la contamination et la contamination croisée. Cet engagement sur la qualification du personnel garantit une exécution sans faille et fiable des tâches essentielles au maintien de l'intégrité du processus de production.
3. Gestion du matériel
Les matières premières et auxiliaires utilisées dans la production proviennent de préférence de matériaux de qualité pharmaceutique, y compris les matériaux d'emballage. Des pratiques rigoureuses de gestion des fournisseurs sont mises en œuvre par le biais de processus tels que la collecte de qualifications, les audits sur site, etc. Les stratégies de contrôle de la qualité sont soigneusement formulées sur la base d'une évaluation complète des risques, en particulier dans le domaine du contrôle microbiologique, afin de garantir l'intégrité des matériaux utilisés dans le processus de production.
4. Processus de production et contrôle de la qualité
Les points clés du contrôle aseptique dans le processus de production sont les suivants :
| Production Environment | Raw Material Preparation: ISO Class C and A Drug Product Production: ISO Class B and A Dynamic environment monitoring |
| Solutions and Process Gases | 0.1μm / 0.22μm sterilizing filtration Drug product production with secondary sterilizing filtration Integrity testing before and after filter use |
| Single-Use Consumables | Gamma irradiation sterilization Integrity check before use |
| Process Control | Aseptic connections Bacterial endotoxin control Aseptic process simulation filling |
| Equipment Control | Cleaning processes and cleaning confirmation for reusable equipment |
| Cleaning and Disinfection | Disinfectant efficacy verification |
| Quality Control | Microbial limits control for raw materials Sterility testing of products complies with USP |
Culture cellulaire en amont :
• Dans les phases de production de cultures cellulaires, une réglementation stricte régit les exigences en matière de tenue et de comportement du personnel afin de minimiser les risques de contamination lors des opérations.
• Les étapes de récupération des cellules et d'expansion des flacons sont effectuées dans une zone propre de classe C pour environnement d'arrière plan. Les opérations ouvertes sont effectuées dans une enceinte de sécurité biologique de classe A sous protection laminaire, avec un contrôle environnemental dynamique simultané. Pour garantir des conditions aseptiques, les étapes d'expansion du réacteur et de culture par perfusion intègrent des systèmes fermés jetables, avec une technologie de soudage stérile pour des processus tels que l'inoculation, l'alimentation et d'autres processus afin d'éviter efficacement la contamination microbienne.
• Au cours de la phase de culture cellulaire, les matériaux utilisés sont soumis à un contrôle rigoureux des endotoxines et ne sont utilisés qu'après avoir satisfait à des critères stricts qualité pour la libération. La préparation des milieux de culture et des solutions est conforme aux exigences de la pharmacopée pour l'eau d'injection. Après préparation, les solutions sont stérilisées en passant à travers des filtres de 0,1μm/0,22μm, et l'intégrité des filtres est testée. Simultanément, des tests de stérilité sont effectués et les solutions ne peuvent être utilisées pour la production de cultures cellulaires que si les deux tests donnent des résultats satisfaisants. Les gaz utilisés dans le processus, tels que le dioxyde de carbone, l'oxygène et l'air comprimé, répondent à des normes de haute pureté ou de qualité alimentaire. Les gaz de traitement connectés au réacteur subissent une stérilisation efficace en passant par un filtre de 0,22μm. Les consommables jetables, y compris les sacs de réaction et les sacs de stockage, sont stérilisés par irradiation afin de garantir la stérilité des matériaux en contact direct avec le liquide, qui ne doivent pas être contaminés par des micro-organismes.
• Les membranes de filtration en profondeur utilisées pour la filtration de clarification sont à usage unique. Avant d'être utilisés, les emballages des membranes sont rincés avec de l'eau d'injection afin d'éliminer les impuretés qu'ils contiennent. Après la filtration de clarification, le liquide subit une seconde filtration à travers un filtre de 0,22μm pour réduire efficacement la charge microbienne avant d'entrer dans les processus de purification en aval. Avant de passer à la purification en aval, le liquide clarifié récolté est soumis à un test d'endotoxines pour s'assurer que le produit intermédiaire répond aux exigences du processus.
Purification en aval :
• Les colonnes de séparation et les milieux chromatographiques utilisés dans le processus de purification sont exclusivement dédiés au projet spécifique, ce qui évite les risques de contamination croisée entre les différentes étapes de production. Après la production de chaque lot, le système chromatographique subit un nettoyage complet, confirmé pour les lignes de nettoyage sur la base d'une évaluation des risques. Les milieux pour lhromatographie, conformément aux procédures écrites, sont nettoyés et stockés de manière appropriée, subissant un nettoyage ultérieur avant la production du lot suivant, pour réduire efficacement l'impact des micro-organismes. Les méthodes de contrôle microbien des matériaux et consommables en contact direct avec les produits au cours de l'étape de purification reflètent celles de l'étape de culture cellulaire, ce qui permet d'éviter l'introduction de micro-organismes. Les équipements et instruments réutilisables sont stérilisés à la chaleur humide pour maintenir leur stérilité.
• Après séparation et chromatographie, le liquide subit des processus de nanofiltration et d'ultrafiltration, qui culmine avec une filtration stérilisante à l'aide d'un filtre de 0,2μm. Après filtration, le liquide est rempli sous protection de flux laminaire de grade A pour réduire la contamination microbienne de l'environnement. Le liquide en vrac est soumis à divers tests, y compris des limites microbiennes et des évaluations d'endotoxines, conformément aux normes de qualité. Après avoir passé ces tests et reçu l'approbation du service qualité, le liquide passe au remplissage du produit final.
Produit formulé :
• Le remplissage du produit fini suit un processus de production aseptique à stérilisation non terminale, garantissant un environnement de production B+A strict. Après la filtration stérilisante, le produit semi-fini est acquis. L'assemblage, le remplissage, le capsulage, le chargement et le déchargement automatisés et la lyophilisation sont effectués à l'aide d'équipements entièrement automatisés et de systèmes de remplissage aseptique à usage unique dans un environnement aseptique de classe A (système de surveillance continue de l'environnement PMS). Après la lyophilisation, le scellage est effectué dans un environnement C+A. Les produits emballés font l'objet d'une inspection visuelle manuelle, d'un étiquetage et d'opérations supplémentaires. Elles ne sont placées dans l'entrepôt des produits finis et libérées qu'après l'inspection.
• La validation rigoureuse du processus aseptique comprend la confirmation régulière du contrôle du processus aseptique, y compris l'utilisation de milieux nutritifs aseptiques et/ou de substituts de produits dans des APS (flacons de simulation de milieux). L'APS évalue toutes les opérations aseptiques effectuées depuis la stérilisation et le nettoyage des matériaux jusqu'au scellement des conteneurs. Les milieux sont soumis à des tests de promotion de la croissance afin de garantir des résultats de culture fiables. L'expérience de pénétration microbienne permet de garantir l'intégrité de l'étanchéité du système d'emballage du produit, ce qui assure la stérilité du produit pendant le stockage.
• Contrôle de la qualité des produits finis : Le test de stérilisation est l'étape finale pour garantir la stérilité parmi une série de mesures de contrôle critiques. Les tests de stérilité sont effectués à l'intérieur d'un isolateur aseptique, et l'échantillonnage pour les tests de stérilité comprend des produits au début et à la fin du remplissage du lot pour la représentation. Les méthodes d'analyse de la stérilité respectent strictement les exigences de la pharmacopée, en utilisant des souches autorisées par l'ATCC et le CMCC, et en suivant les exigences de la pharmacopée pour la culture des produits biologiques afin de garantir la fiabilité des résultats.
En résumé, les produits de qualité BPF/GMP d'ACROBiosystems sont fabriqués selon des stratégies de protection aseptique complètes, un contrôle de qualité rigoureux et en conformité avec les réglementations BPF/GMP. Ces processus aseptiques soutiennent l'enregistrement et la commercialisation des produits de TCG.
• Contrôle des contaminants externes dans la production de matériaux critiques pour les thérapies cellulaires et géniques.
• Stratégies de protection aseptique pour la production de matériaux critiques pour les TCG
• Système de contrôle de la qualité pour les matériaux critiques des TCG
• Système global de sécurité de la chaîne d'approvisionnement pour les matières critiques des TCG
• Comment mieux répondre aux exigences réglementaires des États-Unis pour les matériaux critiques pour les TCG
• ...


This web search service is supported by Google Inc.
