 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> GMP準拠のサイトカイン製品
一貫性の高いGMP製品は、細胞療法医薬品の製造における主要な原材料として不可欠です。当社は規制ガイドラインを遵守し、医薬品製造に高品質で安全かつ高生物活性の製品を提供するよう努めております。

GMPサイトカインと成長因子は細胞療法医薬品の製造プロセスに使用されます。当社はタンパク質の開発と製造において、長年の経験と厳格な品質管理体制を持ち、業界をリードするGMPタンパク質を提供できます。規制を満たすためのサポートも充実です。GMPへの技術移管を可能な限りシームレスにするために、研究グレードの材料と同じクローン、配列、発現システムを使用することを推奨します。

高品質のGMP製品を手頃な価格で提供することで、細胞療法などの革新的な医薬品へのアクセスを簡易化にできます。当社の新たなGMP施設では、タンパク質、酵素、活性化ビーズなどのGMP製品は設計し、製造されています。
Want to learn more about
your GMP Protein options?
バルク中間体から最終凍結乾燥製品までの全製造工程にわたる品質管理テストにより、当社のGMPグレード製品がお客様のニーズを満たし、準拠していることが保証されます。当社は包括的な品質管理システムを通じて、すべてのGMPソリューションの生物活性、一貫性、安定性を確保しています。
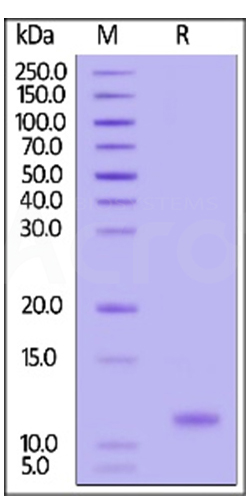
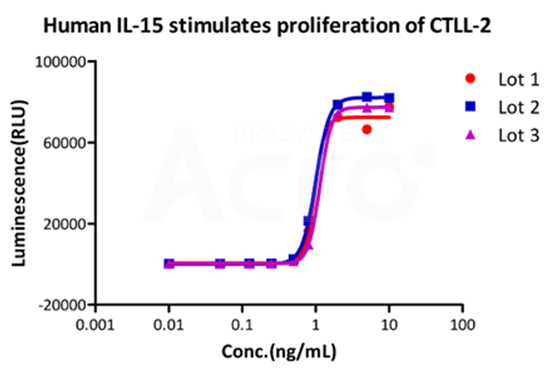
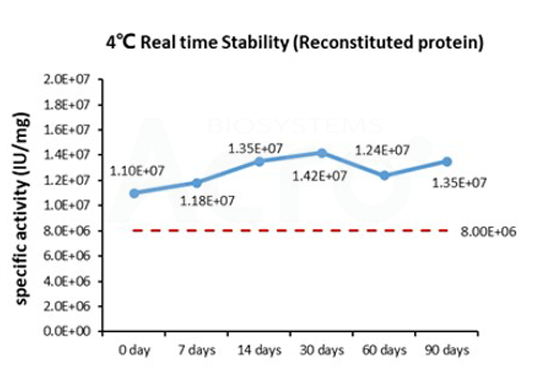
Three independent lots of GMP Human IL-15 (Cat. No. GMP-L15H13) were tested for the ability to simulate the proliferation of CTLL-2 cells. Average specific activity of GMP Human IL-15 was defined to be more than 0.8 x 107 IU/mg after calibration against human IL-15 WHO International Standard (NIBSC code: 95/554).
Human IL-2, GMP-grade
Human IL-7, GMP-grade
Human IL-15, GMP-grade
Explore >>
Request a protocol for GMP-grade IL-15 Bioactivity Verification
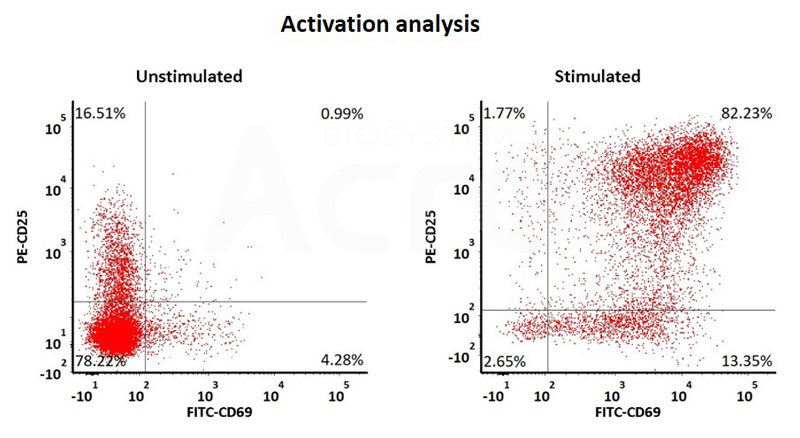
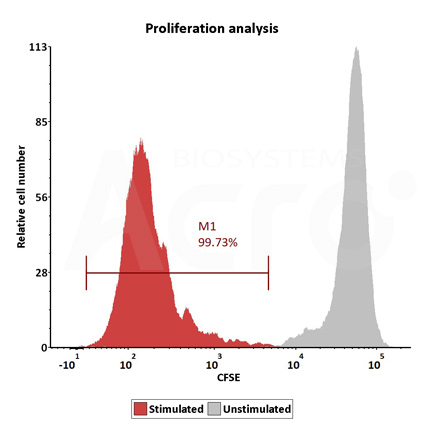
Human T cells were stimulated using GMP-grade ActiveMax Human T Cell Activation / Expansion CD3/CD28 beads (Cat. No. GMP-MBS001 ) for 24 hours. Activation was assessed by measuring expression of both activation markers CD25 and CD69 expression on T cell surface by staining with PE labeled anti-human CD25 antibody and FITC-labeled anti-human CD69 antibody respectively (QC tested).
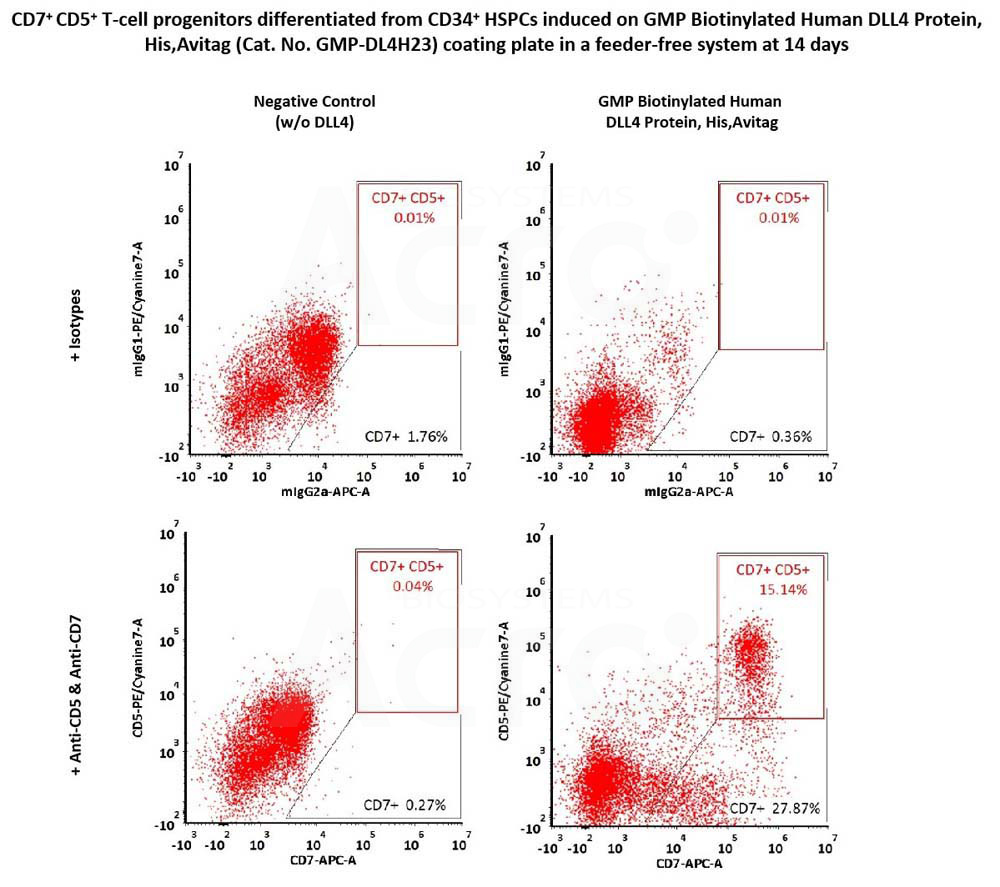
CD34+ CD45+ hematopoietic cells were seeded on GMP Biotinylated Human DLL4 Protein, His,Avitag (Cat. No. GMP-DL4H23) coated plates and differentiated for 14 days, then flow cytometry was used to detect the expression of T-cell progenitor markers, CD7 and CD5. The GMP Biotinylated Human DLL4 Protein, His,Avitag together with SCF, TPO, Flt3L and IL7, could induce the formation of CD7+ and CD7+ CD5+ T-cell progenitors (Routinely tested).
DLL4, Fc tag, GMP-grade
Biotinylated DLL4, His, Avitag, GMP-grade
VCAM-1, GMP-grade
Explore >>

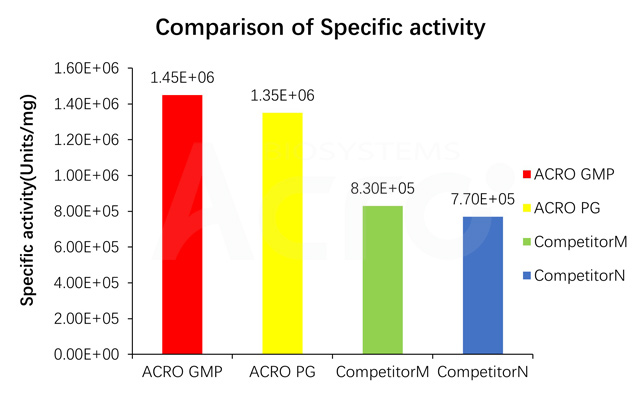
Specific activity for GMP GENIUS Nuclease is measured under standard assay conditions. The specific activity of GMP GENIUS Nuclease, is >1.2E+06 unit/mg protein. One unit will digest sonicated salmon sperm DNA to acid-soluble oligonucleotides equivalent to a ΔA260 of 1.0 in 30 min at pH 8.0 at 37 °C, which corresponds approximately to complete digestion of 37 μg DNA.
Salt-Active GENIUS Nuclease, GMP-grade
NLS-Cas9 Nuclease, GMP-grade
Explore >>
Interested in testing
a GMP grade product ?
お客様のニーズに合ったソリューションを、アプリケーション別で検索していただけます。当社は現在T細胞、NK細胞、樹状細胞などの免疫細胞の細胞製造を支援するために設計された幅広い製品を提供しています。急速に増加しているiPSC成長因子と分化因子のカタログも提供しております。DLL4、VCAM-1などの組換えタンパク質なども含まれています。基底膜抽出物と細胞外マトリックス タンパク質もご利用いただけます。
お探しのものは見つかりましたでしょうか。当社のソリューションカタログから、最適なものをご利用ください。当社のGMP Gradeソリューションは、細胞療法製造プロセスにおける原材料の規制ガイドラインに従って製造されています。GMPのほか、プレミアム(Pre-GMP)グレード ソリューションも用意しており、GMPへの移行を効率化するための製品も提供しております。
| Molecule | Source | GMP Grade Catalog No. | DMF Filed for GMP Grade | Premium (Pre-GMP) Grade Catalog No. |
|---|
*Already purchased a DMF-filed protein? Click here to apply for your DMF authorization.
Can’t find the
GMP Product you need?

この15分間のウェビナーでは、患者の安全性、ロット間の一貫性、サプライチェーンの信頼性を確保するために、適切な原料サプライヤーをパートナーとして選択することがいかに重要であるかを紹介されます。
当社は、細胞および遺伝子治療の臨床研究および商品化に使用するための高品質のコア試薬の開発に取り組んでいます。現在の医薬品製造慣行とより厳格な品質管理と出荷検査基準に従い、良質のGMP Grade製品をお客様に提供できるよう努めています。当社は、細胞・遺伝子治療製造の世界的な規制要件を満たす原材料を製造するために、GMP品質管理システムを継続的に改善しています。当社は、すべての顧客監査を歓迎し、コンプライアンスを確保するために自社施設を定期的に監査しています。
全てのGMPタンパク質は、GMP準拠の施設で生産し、品質検査を受けています。当社のGMP品質管理システムは、cGMPとGMPガイドラインに従って開発し、維持されています。
主な特徴は次のとおりです。
全てのGMPタンパク質は、GMP準拠の施設で生産し、品質検査を受けています。当社のGMP品質管理システムは、cGMPとGMPガイドラインに従って開発し、維持されています。主な特徴は次のとおりです。
Want to learn more about
your GMP Protein options?
細胞療法および遺伝子療法の最終製品内の外来性汚染物質は、大きな懸念事項です。外部汚染物質を最小限に抑えるには、厳格な品質管理システムが必要です。GMP Gradeの製品は、規制当局によって概説されたGMPガイドラインを参照し、製造および品質管理プロセス全体を通じて定期的に実行されます。
当社の専門的な規制サポートチームは、中国、米国、韓国などの顧客を抱える世界中の医薬品メーカーと連携した経験があります。CDE、FDA、KFDAの宣言は、当社のサポートを受けて提出されています。当社は、開発のさまざまな段階と宣言要件の使用において顧客を支援するために、規制サポート ファイル ドキュメントを提供しています。
Learn More About our GMP Facilities & Capabilities 
Want to learn more about
your GMP Protein options?
RUO Gradeのタンパク質からGMP Gradeのタンパク質への移行の準備となると、いつ切り替えを開始すればよいかを正確に把握するのは難しいとされています。当社では、業界でよく聞かれる質問をまとめることによって、GMP原材料の利用に関する規制状況について理解を深め、安心して臨床段階に入ることをサポートします。
Learn more about making the transition to GMP here!
原材料は、事前に確立されたサプライヤーの適格性確認とモニタリングプロセスに従い、適格なサプライヤーから調達されるべきである。私たちは、サプライヤーとともに、GMPプロセスで使用される原材料のリスクアセスメントを毎年実施しています。これには、分析証明書(CoA)、原産地証明書(CoO)、TSE/BSE宣言書、該当する場合はアニマル・フリー声明書など、関連文書の目視検査と文書追跡が含まれます。受領する前に、主要原材料は常に特定され、検証されます。
細胞療法医薬品メーカーには、可能な限り医薬品グレードまたは GMP Gradeのいずれかを調達することをお勧めします。当社のGMPグレード製品は、関連する国際基準に従って製造およびテストされています。 * 原材料サプライヤーは、ISO 9001/13485認証とともに、認定品質管理システム(QMS)を備えている必要があります。顧客の期待に応える品質を確保するために、独立した監査、品質ポリシー、品質プロセスを確立する必要があります。細胞療法医薬品メーカーは、アンケート、納期厳守、SCARなどの監査活動を通じてサプライヤーを評価することにより、デューデリジェンスを実行する必要があります。分析証明書、原産地証明書などの監査証跡文書を各サプライヤーから受け取り、記録として保管する必要があります。細胞療法医薬品メーカーは、生産開始時に問題を回避するために、できるだけ早く潜在的なサプライヤーとのコミュニケーションを開始する必要があります。原材料サプライヤーがスケールアップできることを確認することで、直前での変更を防ぐことができ、高価な再検証研究が必要となる可能性があります。候補となるサプライヤーを特定することも重要です。原材料は同一に見えても、それが生物学的システムでどのように動作するかは保証されません。サプライヤーの切り替えは簡単にできると考えないでください。異なるサプライヤーの原材料の同等性を示す検証研究がその後に必要です。候補となるサプライヤーを特定しておくことは、一次サプライヤーに問題が発生した場合の保険となります。
*International standards include:
製造された細胞および遺伝子治療薬の品質は、製造に使用される原材料に直接影響され、それが治療の効果と有効性に影響します。各国のガイダンスでは、原材料の選択では必要性、合理性、安全性を考慮した上で、できればヒトでの使用が承認済みの薬局方基準を満たしている原材料を選択することが規定されています。原材料の安全性と品質の要件は初期の前臨床段階では優先順位が低くなりますが、CMCまたは臨床への移行中に規制に準拠したGMP Gradeの原材料への移行が必須になります。この移行には徹底した検証、安全性評価、プロセス検証が含まれ、たくさんの時間と労力が必要です。当社をサプライヤーとして利用した場合、プレミアムグレード(PG)原材料の物理的特性と生物学的活性は、規制サポート文書が異なるだけで、理想的にはGMP Gradeのものと同等です。患者に影響を与える原材料の厳格な安全性テストは重要であり、PG材料とGMP材料間の製造プロセスの一貫性を確認できます。当社では、PG製品とGMP製品の両方が同じ細胞バンク から得られ、厳格な品質管理を受け、広範囲にわたる試験を通じて生物学的同一性が実証されています。臨床応用の場合、前臨床段階であっても早期にGMPに移行することをお勧めします。これにより、より管理しやすい段階で同等性テストを実施しやすくなります。品質管理、タンパク質生化学、分析テスト、規制業務に精通した経験豊富なサプライヤーを選択することが有利です。経験豊富なサプライヤーは、規制環境の変化に対応し、ドラッグ マスター ファイル(DMF)などの必要な文書を提供して規制プロセスをクリアできます。サプライヤー施設の監査(できれば対面またはオンライン)により、サプライヤーと顧客間の戦略的パートナーシップが強化されます。承認された操作手順を少なくとも3つの連続ロットにわたって厳格に遵守することで、GMP製品ラインを通じて開発されたPG製品の一貫性と所定の承認基準への適合が保証されます。
生物学的試薬は、特にサイトカインや成長因子については、動体的な影響を受けやすいとされます。当社の試薬が、厳格な仕様を満たす複数の連続ロットを通じて開発し検証され、安定したプロセスと厳格な適合性評価が確立されて初めて、製品は大規模製造に移行して商品化にしています。このプロセスは、GMP原材料の一貫性と信頼性を確保するための強固な基盤となります。さらに、製品の製造はGMP施設内においてGMP品質システムの下で行われ、文書化された標準操作手順(SOP)と訓練を受けた人員を通じて厳格な管理が実施されます。これらの要素は、監査中に開示される必要があります。サプライヤーが再現可能なタンパク質を一貫して製造する能力を評価するために、複数のロットからデータを要求するのは合理的です。理想的には、材料はさまざまなロットからサンプリングして、システム全体での一貫性を評価する必要があります。当社は標準ロットを特定し、製品化にする前に、確立された標準と新しい製造ロットを比較します。このアプローチにより、ばらつきが軽減され、一貫した製品パフォーマンスが保証されます。現在、当社ではロット間の差異、特に生物学的活性を10~15%の範囲内にし、優れた管理で品質を維持しています。
細胞・遺伝子治療の製造に使用されるあらゆる原材料の安全性は、最終的に治療品質を保証するために重要です。これは、外因性因子による汚染を防ぐための安全管理でも必要性を強調されています。これらの「外因性」因子とは、接種物、細胞マトリックス、製造中の残留原材料、細菌、真菌、マイコプラズマ、ウイルスのことです。最高品質の材料を使用するというFDAの推奨は、すべての原材料サプライヤーが、患者への不必要なリスクを軽減するために、原材料または試薬が適切な品質基準に従って製造するべきです。つまり、CGT製造に使用される原材料の厳格な品質管理は、外部汚染のリスクを軽減し、細胞・遺伝子治療製品の安全性と有効性を確保するために必要な手段です。この要件について、さまざまな国際薬局方に次の要件が概説されています。
Making the Transition to GMP Brochure 
The Balancing Act: Why Finding the Right Time to Introduce GMP Is Your Secret to Success 
Quality Management and Safety Evaluations for GMP 
Understanding Global GMP Regulatory Guidelines 
GMP Regulations Frequently Asked Questions 
Infographic - Production Process & Quality Control Workflow 
Qualifying Raw Materials for Cell Therapy Manufacturing 
Special Topic on Deep Interpretation of GMP Product Quality 1 
Looking for your next
GMP Supplier?
This web search service is supported by Google Inc.
