Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>






























 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions

많은 혈액 및 고형 악성 종양은 면역관문(IC) 발현을 방해함으로써 우리의 자연적인 항종양 면역성을 벗어날 수 있습니다. 면역관문(IC) 억제제는 유망한 면역 요법으로서 세포독성 T 림프구와 자연 살해 세포의 활동을 재조절하여 타고난 면역력을 재구축하고 증강합니다. 세포독성 T 림프구 항원(CTLA-4), 예정된 세포 사멸(PD-1) 및 그 리간드(PD-L1) 등 IC를 표적으로 삼는 치료법이 다양한 암을 치료하기 위해 FDA의 승인을 받았습니다.1
예상과는 달리 IC 요법은 종종 대부분의 환자에서 반응을 보이지 않는데, 이를 1차 내성이라고 합니다. 초기에 반응하는 다른 환자의 경우 내성이 발생하고 후천적 내성으로 정의되는 종양 재발을 경험할 수 있습니다.2전체적으로 소수의 환자만이 IC 억제제 요법에 반응하므로 임상 적용에는 제한이 발생합니다. 따라서 믿을 만한 관련 기제를 탐구하고, 치료 효과를 개선하기 위한 새로운 IC 또는 병용요법 전략을 찾는 연구로 중점을 옮겼습니다.
IC 억제제 내성 기전은 일차 또는 후천으로 분류됩니다. 여기에는 면역 인식, 세포 신호 전달, 유전자 발현, DNA 손상 반응 및 T 세포 활성화 과정 등의 암세포 변이가 포함됩니다.3 현재 몇 가지 내성 기저가 확인되었습니다. 본 논문에서는 일차 및 후천 내성에 기여하는 주요 기저를 연구합니다.
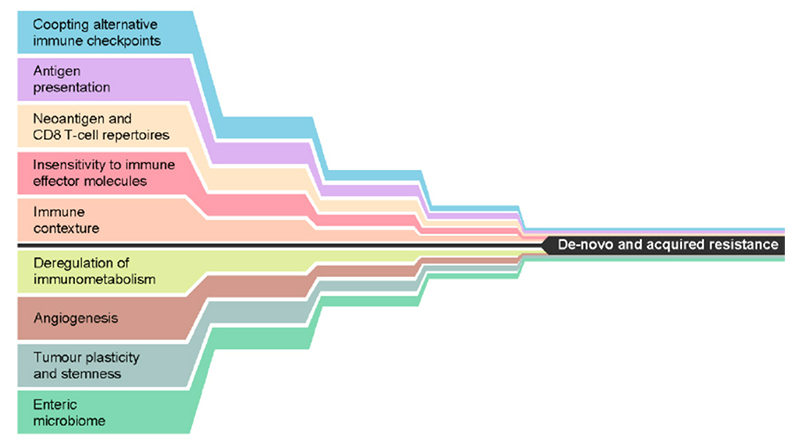
Figure 1. Mechanisms that may either alone, or in combination, lead to de novo or acquired resistance to immune checkpoint inhibition. Reproduced from Fares, et al. 3
종양미세환경으로도 알려진 면역 구조는 암세포 외부의 면역 인자를 나타냅니다(면역 및 기질 세포, 사이토카인 및 치료 반응에 영향을 미치는 기타 생물학적 제제). 이 미세환경 내부에서 분자 및 세포 구성이 변경되어 면역 억제 환경을 확립합니다. 조절 T 세포(Treg), 골수 유래 억제 세포 및 종양 관련 대식세포는 모두 사이토카인 분비, T 효과기세포 억제 및 상승한 전환성장인자 베타를 비롯한 다양한 방법을 통해 이러한 변화에 기여합니다. 이는 IC 억제제 요법의 1차 내성에 직접적으로 기여합니다.
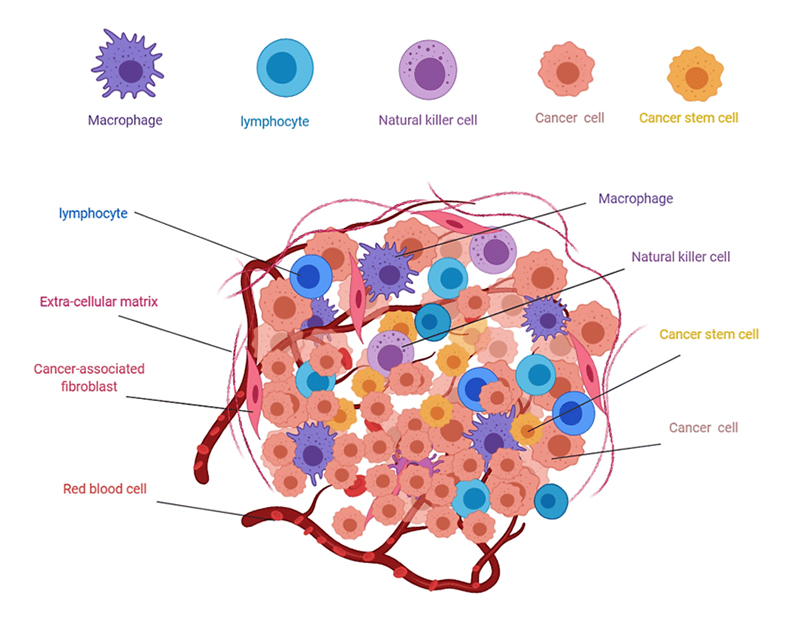
Figure 2.Composition of solid tumors 4
우리의 타고난 면역 반응 중 중요한 부분은 반응의 진화로서, 악성 종양에서 흔히 조종되는 과정입니다. 면역 억제 환경을 생성하는 종양미세환경과 달리 면역 반응의 변화는 T 세포 증식 및 다양화를 억제합니다.
이는 일반적으로 CTLA-4 및 PD-1을 포함한 면역관문의 과발현을 통해 시작됩니다. CTLA-4 및 PD-1 IC 요법에 대한 후천 내성의 경우 대체 면역관문의 과발현이 관찰되었습니다. 대체 IC 수용체에는 뮤신 도메인-3 단백질(TIM-3) 및 림프구 활성화 유전자 3(LAG-3), B 및 T 림프구 감쇠기(BTLA), T 세포 면역수용체 티로신 기반 억제 모티프 도메인(TIGIT) 및 T 세포 활성화의 V-도메인 면역 글로불린 함유 억제제가 있습니다.
다중 면역관문의 공동 발현은 심하게 고갈된 T 세포 상태를 초래하여 효과기 기능 손상, T 세포 기능의 점진적 상실, 전사 상태 변성 및 항원 지속성을 유발합니다. 상향 조절되고 동시 발현되는 면역관문의 경우, 이러한 대체 관문수용체를 표적으로 삼거나 공동 표적으로 삼으면 후천 내성 예방을 위한 해법이 될 수 있습니다.
끝으로, IC 요법에 대한 마지막 내성 기저는 종양 면역원성이며, 면역 효과기 분자에 대한 민감도로도 알려져 있습니다. 종양 면역원성은 외래 또는 종양변이부담(TMB)으로 인식되는 면역원성 신생항원의 수로 측정할 수 있습니다. 면역 체계와 상호 작용하는 이종 종양은 낮은 TMB 종양을 우선적으로 선택합니다. 이러한 현상은 Anagnostou et al.의 비소세포폐암종(NSCLC)에 관한 연구에 나와 있듯이 후천 면역의 주된 원인입니다.4
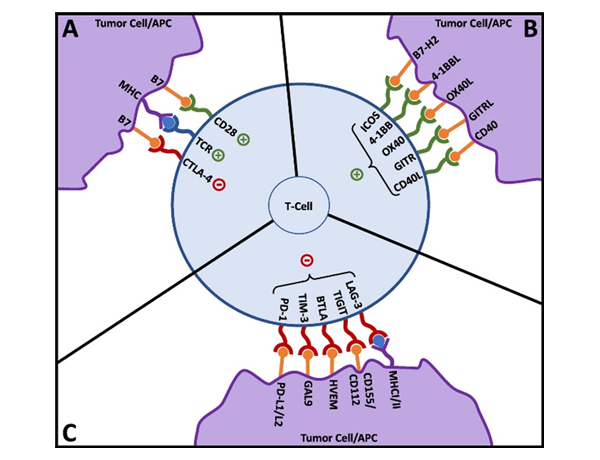
Figure 3. T-cell activation and co-signaling. Reproduced from Fares,et al. 3
위에서 강조한 내용을 바탕으로, IC의 타고난 면역 체계를 이끄는 기능은 분명합니다. IC의 과발현 및 과소발현은 면역 억제 TME를 형성하고 면역 반응 진화를 변경하는 추진 요인으로 볼 수 있습니다. 그러나 IC 억제제 요법에 대한 반응의 변화는 IC 억제제 내성의 복잡성과 발견되지 않은 기제의 존재를 의미합니다. 이와 같이, 새로운 IC 억제제 요법의 개발은 내성 기전을 극복하고 현재 면역 요법의 제한된 적용 범위를 확대할 가능성이 있습니다.
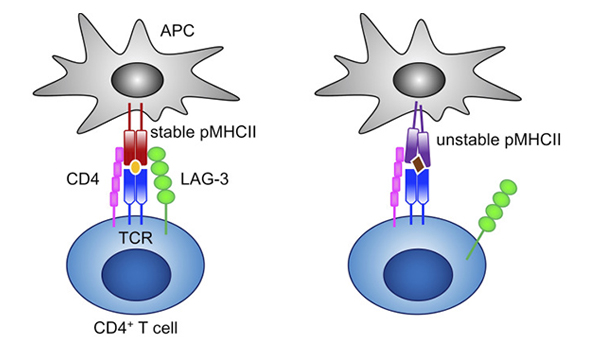
Figure 4.LAG-3 selectively binds to stable pMHCII and inhibits the activation of CD4+ T cells that recognize stable pMHCII. 6
주목할 만한 IC 억제제 중 하나는 LAG-3입니다. LAG-3는 T 세포 사이토카인 생성, CD4/8 확장을 하향 조절하는 주요 면역억제 분자로, 조직 손상 및 자가면역을 방지하기 위해 Treg 채택을 선호합니다.5 LAG-3를 차단하면 종양 세포에 대한 면역이 활성화되고 다른 IC 억제제도 더욱 향상됩니다. 임상적으로 LAG-3와 PD-1 요법을 함께 사용하면 치료 효과가 증가하는 반면 LAG-3 단독 요법은 중간 정도의 반응만을 나타냅니다. 2022년 3월에 LAG-3/PD-L1 병용요법(Opdualag)은 절제 불능성 또는 전이성 흑색종에 대해 FDA의 승인을 받았습니다.6 100건 이상의 임상 시험에서 LAG-3 억제제에 대한 평가가 진행 중이며 IC 요법으로서의 가능성을 더욱 강조하고 있습니다.
가능성이 있는 또 하나의 IC 표적은 TIM-3입니다. TIM-3는 CD4/8 T 세포, Treg, 골수 세포, NK 세포 및 비만 세포를 비롯한 다양한 면역 세포에서 발현됩니다.7
TIM-3의 세포 다양성은 다중 세포 경로를 통한 면역 반응 조절을 초래합니다. 현재 선천성 면역에서 TIM-3의 병태생리는 아직 분명하게 밝혀지지 않았으나, 다양한 세포 경로에 걸쳐 나타나는 그 기능과 중요한 전임상 데이터는 면역관문으로서의 TIM-3를 뒷받침하며, 이로써 암 외에도 다양한 질병에 대한 면역 요법으로서 유망한 치료 방법이라는 점을 나타냅니다.
면역 요법의 가능성은 매우 크나, IC 억제제 요법은 일차 또는 후천 내성의 유병률 및 한정된 적응증으로 인해 그 사용이 제한적입니다. 이는 부분적으로 면역관문 및 내성 기제에 대한 불완전한 이해와 치료용으로 실제 사용할 수 있는 면역관문 표적의 수가 제한되어 있다는 점에서 비롯합니다. 임상적으로나 생물학적으로나 현재의 지식에는 미비점이 있으나, 면역 요법의 초기 유망한 결과와 지속적인 반응은 무시할 수 없습니다. 우리의 타고난 방어력의 비밀을 풀기 위한 면역 요법의 가능성은 막대합니다.
혁신적인 면역 요법에 대한 연구를 촉진하기 위해 ACROBiosystems는 일련의 IC 단백질, 억제제 스크리닝 키트 및 과발현 세포주를 개발하고 업데이트하는 데 전념하고 있습니다.
1. Archilla-Ortega, A., Domuro, C., Marin-Liberal, J. et al. Blockade of novel immune checkpoints and new therapeuic combinaions to boost anitumor immunity. J Exp Clin Cancer Res 41, 62 (2022).
2. Bagchi S, Yuan R, Engleman EG. Immune Checkpoint Inhibitors for the Treatment of Cancer: Clinical Impact and Mechanisms of Response and Resistance. Annu Rev Pathol. Jan 24;16:223-249. (2021)
3. Fares CM, Van Allen EM, Drake CG, Allison JP, Hu-Lieskovan S. Mechanisms of Resistance to Immune Checkpoint Blockade: Why Does Checkpoint Inhibitor Immunotherapy Not Work for All Paients? Am Soc Clin Oncol Educ Book. Jan;39:147-164. (2019)
4. Ghmkin H., Seno M. Blood and Cancer: Cancer Stem Cells as Origin of Hematopoieic Cells in Solid Tumor Microenvironments. Cells 9,1293 (2020)
5. Anagnostou V, Smith KN, Forde PM, et al. Evoluion of neoanigen landscape during immune checkpoint blockade in non-small cell lung cancer. Cancer Discov. 7:264-276 (2017)
6.Maruhashi T., Okazuki T., et al. LAG-3: from molecular funcions to clinical applicaions. J. Immunother Cancer. 8(2):e001014 (2020)
7. Marin-Acevedo, J.A., Kimbrough, E.O. & Lou, Y. Next generaion of immune checkpoint inhibitors and beyond. J Hematol Oncol 14, 45 (2021).
8. Food and Drug Administraion. FDA approves Opdualag for unresectable or metastaic melanoma (2022).
9. Wolf, Y., VK Kuchroo, et al. TIM3 comes of age as an inhibitory receptor. Nature Reviews Immunology 20, 173-185 (2020).
This web search service is supported by Google Inc.








