 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions

近年、バイオ医薬品業界は目覚ましい成長を遂げており、持続する技術的進歩の中の重要な分野として細胞・遺伝子治療 (CGT) が台頭しています。次世代医薬品の中で生物学的製剤が大きなシェアを占めるようになると、これらの生物学的製剤の安全性を確保することが最優先事項となります。安全性の確保のため、細胞・遺伝子治療の最終製品に対してだけでなく、製造および生産時に使用する原材料に対しても監視が向けられます。さらに、適切な「最高品質」の原材料の使用を強調している FDA によって、この点が明白に示されています。同様に、国際医薬品規制計画の細胞療法作業部会では、ヒト用 CGT 製品の製造および認可での高品質の原材料使用に関する見解を伝えるために審議文書案を作成されました
規制当局が「高品質」な原材料の使用を強調する場合、細胞療法製品の製造業者にとってどのような意味があるのでしょうか。
細胞療法メーカーは、供給業者から入手したものでも、自社で開発したものでも、原材料の品質を保証するために正当な注意義務を負わなければなりません。
サイトカインや他の成長因子などの該当する原材料の品質管理方法および基準の評価が、臨床研究を進める前の新薬臨床試験開始届 (IND) の申請に必要なステップです。これらの方法と基準は、いくつかの情報源から得られます。米国薬局方や、欧州医薬品品質理事会 (EDQM) などの組織に由来する薬局方の方法は、製造および販売の基本的な要件を定める標準化アプローチです。薬局方以外の、日米 EU 医薬品規制調和国際会議 (ICH) 文書などの方法は、製品とその製造プロセスに固有の特性を評価するために調整された補足的な分析アプローチです。
現在、多くの市販製品がこれらの基準に従って、通常は「GMP Grade」または「cGMP Grade」の表示で販売されています。ただし、定められた基準に準拠した製品は、多くの場合、自主規制です。そのため、正当な注意義務を果たす責任は依然として細胞療法製品の製造業者にあるため、信頼できる供給業者を見つけることが困難な場合があります。
本書では、IND 要件を満たし、臨床試験相に順調に移行する上で重要な GMP Grade原材料の品質管理システムに関する 3 つの主要な側面を明らかにします。
原材料の安全性の評価は、危害を引き起こす、または最終治療薬に影響する可能性のある残留物を抑制するための、さまざまな汚染物質の管理および検出戦略で定義されています。これには、無菌試験と、エンドトキシン、マイコプラズマ、宿主細胞由来残存 DNA、宿主細胞由来残存タンパク質などの汚染物質の評価が含まれます。
• 米国薬局方<71>無菌試験法
最終的な細胞・遺伝子治療製品の無菌性を保証することは困難です。最終治療薬は細胞であるため、滅菌ろ過やオートクレーブなどの簡単な方法は存在しません。したがって、製造業者は最終製品の無菌性を保証するために、製造プロセス全体を通じて細心の注意を払う必要があります。これは、使用する原材料にも当てはまることで、製造業者は供給業者を厳格に評価する必要があります。そのため、当社を含む GMP Grade製品の製造業者向けの原材料供給業者は、B+A クリーンルーム内での自動充填仕上げ、オンライン環境モニター、米国薬局方に準拠した無菌試験を取り入れ、サイトカインや他の成長因子を厳格に管理することが要求されます。そのため、原材料の無菌性評価は、最終治療薬の無菌性を保証するための基本的な方法です。詳細については、 GMP 製品品質の詳細な解説に関する特別トピック - トピック 2 をご覧ください。
• 米国薬局方 <85> エンドトキシン試験法
エンドトキシンは細菌細胞中に存在し、細胞の分解後に放出される毒素で、ボツリヌス中毒などの疾患を引き起こす可能性があります。生物学的製剤中のエンドトキシン濃度を低く保つことが、患者の安全性を保証し、エンドトキシン関連疾患を防ぐために不可欠です。数種類の方法が許容されています。定性的ゲル化法、LAL による比色法。ただし、一貫性がない結果や相反する結果が得られた場合は、ゲル化法の結果を信頼すべき結果とみなします。社内では、米国薬局方標準品のエンドトキシン校正用標準物質で校正した LAL 法を使用し、表 1 に示すサンプルの結果を用いて真度を確保しています。その後、エンドトキシン試験法の有効性を確認するために、米国薬局方 <85> に概説されている予備試験を実施して、許容基準を満たすエンドトキシン回収率を 50 ~ 200% の範囲内に定義しています。
表 1. エンドトキシン サンプル曲線の評価
| Theoretical value | Detected value | Recovery rate |
|---|---|---|
| 50 EU/ml | 55.04 EU/ml | 113.0% |
| 5 EU/ml | 5.96 EU/ml | 104.7% |
| 0.5 EU/ml | 0.6 EU/ml | 108.5% |
| 0.05 EU/ml | 0.06 EU/ml | 108.0% |
• 米国薬局方 <63> マイコプラズマ否定試験
マイコプラズマは、細胞培養物や組織培養物中によく見られる汚染物質であり、細胞の増殖や表現型に変化を引き起こします。マイコプラズマの否定試験は、生物学的製剤とその原材料の信頼性を確保する上で非常に重要です。マイコプラズマを評価する場合、そのゴールド スタンダードは培養法のままであり、固体培地上で典型的なマイコプラズマ コロニーの増殖をモニタリングする方法です。他の検証済みの方法として、蛍光色素を使用して細胞表面に存在する特徴的な粒子や繊維状パターンを表示する方法があります。核酸増幅法や酵素活性に基づく方法も使用できますが、細胞培養法に対する適切な検証と比較にも取り組む必要があります。
• 米国薬局方 <509, 1132> 宿主細胞由来残存 DNA およびタンパク質
宿主細胞の DNA およびタンパク質も、安全上のリスクを回避するために許容レベルに抑制する必要がある他の因子です。外来 DNA やタンパク質は、免疫原性反応や発がん性反応を引き起こしやすく、さらなる危害の原因になる可能性があります。これらの不純物を原材料とその後の製造プロセスから確実に除去することが、患者の安全性のために極めて重要です。
当然ながら、他の試験方法や分析方法と同様に、使用した試験が正確であることを確認するためのバリデーションが必要です。上記の米国薬局方の文書には、生物学的製剤の原材料全体で規格化された試験を評価するためのアッセイプロトコルと明確な基準が記載されています。ただし、生物活性などの原材料に固有の評価に関しては、最初に分析方法のバリデーションを実施する必要があり、通常はほぼ ICH Q2 (改訂 1)「分析法バリデーションに関するテキスト (実施項目) および (実施方法)」に従います。
表 2. 検討されるバリデーション特性
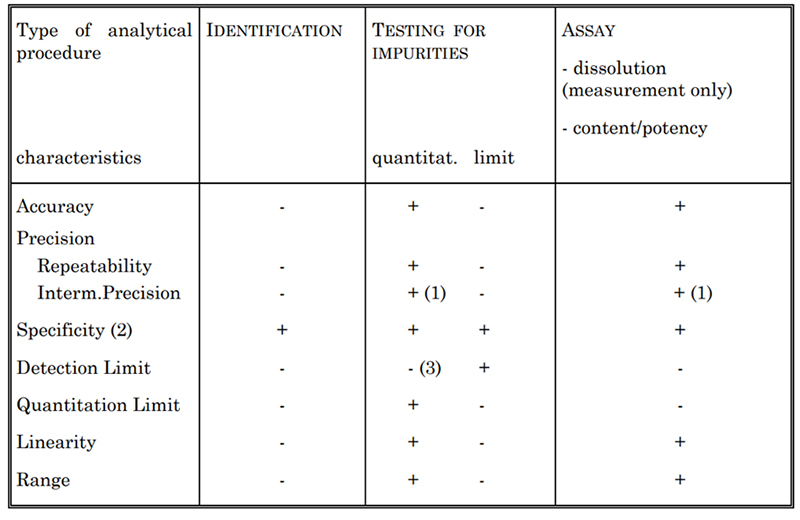
バリデーションする試験法の種類に応じて、表 2 に示すいくつかの特性を一般に評価します。これには、特異性、真度、精度、検出限界、定量限界、直線性、範囲が含まれます。たとえば、サイトカイン濃度を測定するために、UV 吸光度測定試験法や Lowry 法などのさまざまな試験法を確立しています。これらの各方法は、米国薬局方および ICH Q2 ガイドラインに従って完全にバリデーションされています。
表 3. UV 吸光度測定試験法のバリデーション
| Method Validation Parameter | Result | Criteria | Conclusion |
|---|---|---|---|
| Accuracy | Recovery Rate: 96% | Recovery Rate: 90%-108% | Pass |
| Repeatability | RSD: 0.05% | RSD≤3% | Passtd> |
| Intermediate Precision | RSD: 0.48% | RSD≤3% | Pass |
| Robustness | RSD: 0.04% | RSD≤3% | Pass |
| Linearity | R2: 0.99925 | R2>0.999 | Pass |
| Range | 0.0452-0.452 mg/ml | 0.0452-0.452 mg/ml | Pass |
UV 吸光度測定試験法のさらなるバリデーションのために、二次的確証試験法である Lowry 法を使用しました。成熟した定評のある方法の Lowry 法は、比較のための強固な基盤となります。したがって、表 4 に示すとおり、6 種類の標準添加サンプルの定量結果を直接比較することで、UV 法の真度と信頼性を確かめます。
表 4. 二次的確証試験法 – Lowry 法
| Method Validation | Lowry | UV Method | Conclusion |
|---|---|---|---|
| Quantitative Result | 461 ug/ml | 436 ug/ml | Pass |
| 476 ug/ml | 436 ug/ml | ||
| 465 ug/ml | 436 ug/ml | ||
| 472 ug/ml | 436 ug/ml | ||
| 468 ug/ml | 436 ug/ml | ||
| 461 ug/ml | 435 ug/ml |
同一の分析方法のバリデーション フレームワークを使用するために、細胞活性などの他の試験法を含めます。たとえば、当社の TNF-α 試験には、真度、室内再現精度、直線性、範囲が含まれます。ただし、試験の目的により測定基準は異なります。
表 5 TNF-α 細胞活性のバリデーション例
| Method Validation Parameter | Result | Criteria | Conclusion |
|---|---|---|---|
| Relative Accuracy |
Bias:1.1% Slope:1.01 |
Bias within ±12% range & Slope of regression equation between 0.80 and 1.25 | Pass |
| Intermediate Precision | GCV*:11.2% | (GCV)* ≤ 20% | |
| Specificity | Difference % (buffer): 8.8% | Difference % (buffer) ≤ ±10% | |
| Linearity | Correlation Coefficient: 0.97 | Correlation Coefficient ≥ 0.95 | |
| Potency Range | Potency Range: 64% -156% | Range of product efficacy standards (64% -156%) |
*GCV は標準偏差の真数として計算されます。GCV = 真数 (SD)
安定性試験は、製品の保存期間を評価するための基準です。そのため、この試験は、質の高い研究プロセスを目的とする創薬、臨床試験、市場投入、および市販後モニタリング全体にわたり重要な要素です。これは、製品固有の品質および特性に基づいて安定性試験を実施する必要があることを意味します。さらに、安定性試験を体系的に実施することで、ロット間の変動を最小限に抑制すると同時に、出荷時に保管に関する明確な指示も提供できます。
可能な期間内で安定性と一貫性を評価するための、アレニウス式に基づく加速安定性試験法は広く受け入れられた方法であり、近年の多くの研究でその適用範囲と精度が実証されています。欧州標準化委員会発行の文書「EN13640 In Vitro Diagnostic Medical Devices Stability Testing (体外診断用医療機器の安定性試験)」(2002 年) と米国臨床検査標準協会 (CLSI) 発行の文書「EP25A Evaluation of Stability of In Vitro Diagnostic Reagents (体外診断用試薬の安定性に関する評価)」(2009 年) の両方で、体外診断試薬の安定性を測定するこの方法の使用を推奨しています。さまざまな安定性評価パラメータを、表 6 に示します。
表 6. 安定性評価パラメータ

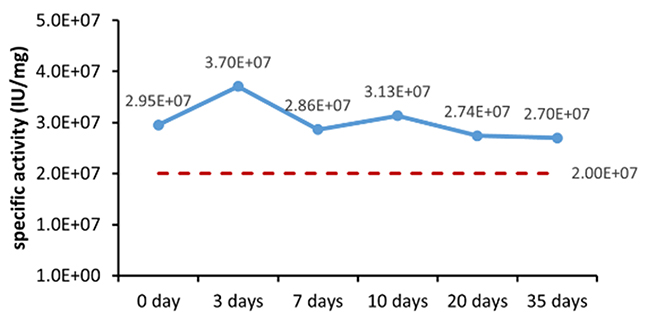
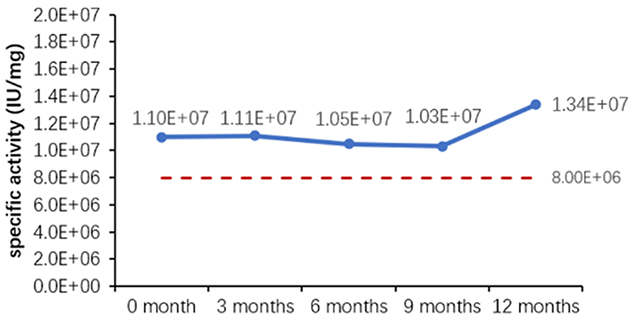
図 1. 最終製品 (粉末) の加速安定性評価 (A) とリアルタイム安定性評価 (B)。
品質管理評価には、通常、指定された要件を満たす、より成熟した感度の高い評価が選択されます。分析方法には潜在的な制限事項があるため、原材料だけでなく最終製品の治療薬も包括的に評価するための同時補完的方法の利用を検討することを推奨します。分析方法自体に対しても厳密なバリデーションを実施する必要があります。十分に確立された厳格で専門的な品質管理システムは、あらゆる治療薬の承認プロセスの合否を左右するものになり得るため、米国薬局方などの薬局方基準を参照する必要があります。このように、医薬品の品質マネジメントに関する国際的な視点は、検査を通じて管理する医薬品の品質から、「製造におけるプロセス管理を通じて達成した医薬品の品質」へ、さらに最終的には「優れた設計を通じて製造される医薬品の品質 (クオリティ バイ デザイン、QbD)」へと進化しています。この QbD の観点を受け入れることは、製品の品質特性と臨床上の安全性および有効性との相関関係を確立することを意味し、プロセス全体および製品ライフサイクル管理全体にわたる包括的な品質管理システムの構築が必要です。そのため、このような考え方を通じて、ACROBiosystems では 自社の GMP 品質管理システムを継続的に改善し、細胞・遺伝子治療製品用の原材料に関して信頼できるサポートを提供できるようにしています。
This web search service is supported by Google Inc.
