Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>































 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> FcRn(新生児Fc受容体)

IgGは母から子に能動的に移動できる唯一の抗体であると考えられています。これは短期間の受動免疫であり、特異的なIgGの輸送はFcRnによって達成されます。1972年に、Jonesらは新生児ラットの腸管内で母体のIgGを新生児に輸送する受容体を初めて発見し、Neonatal Fc receptor (FcRn) と命名しました。FcRnは妊娠・授乳中に発現し、胎盤関門と腸管を越えてIgGを輸送する役割を果たし、ライフサイクル全体の様々な組織細胞で検出されます。主な機能としては、血清IgGと血清アルブミンレベルを維持し、組織内のIgGの分布を調節することです。
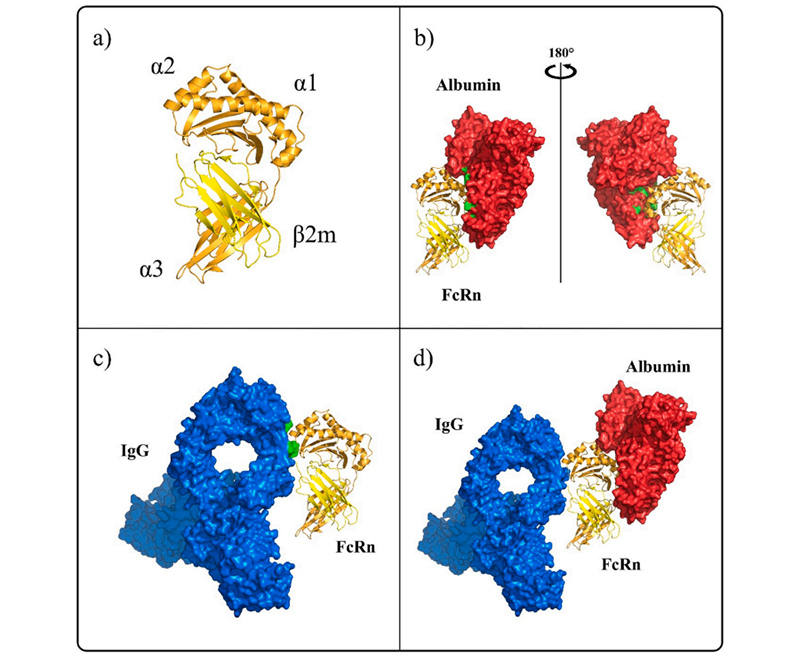 Human FcRn interaction with ligands IgG and albumin
Human FcRn interaction with ligands IgG and albuminFcRnは、FCGRTとB2Mの2つのサブユニットで構成されるヘテロダイマーです。 FCGRTには、3つの細胞外機能領域、α1、α2、α3、膜貫通領域、細胞質尾部領域があります(一部の研究では、細胞質尾部領域は44アミノ酸残基で構成されており、細胞内経路の仲介が含まれている可能性があると考えられています)。分子量は40〜50kDaで、α鎖と呼ばれ、B2Mの分子量は14kDaで、β鎖と呼ばれます。この2つの鎖は非共有結合の形(non-covalent bonds)で結合しています。研究によると、FcRnとIgGの結合部位と血清アルブミンは同じではないため、FcRnとIgGの結合は血清アルブミンによって妨害されません。
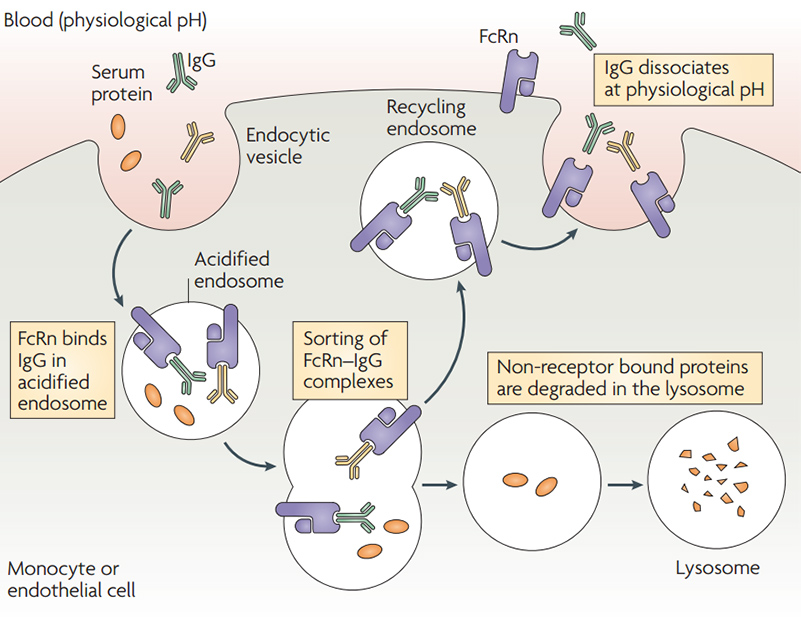 FcRn-mediated IgG and serum albumin recycling
FcRn-mediated IgG and serum albumin recycling![]() HEK293細胞によって発現される:翻訳後修飾の適切なタンパク質フォールディング
HEK293細胞によって発現される:翻訳後修飾の適切なタンパク質フォールディング
![]() 複数種の生物種:ヒト、マウス、アカゲザル/アカゲザル、ラット、ブタ、ウサギ、ネコ、ウシなど様々な種間実験に適しています。
複数種の生物種:ヒト、マウス、アカゲザル/アカゲザル、ラット、ブタ、ウサギ、ネコ、ウシなど様々な種間実験に適しています。
| SDS-PAGE による検証では:純度95%以上 |
SEC-MALS による検証では:純度95%以上 |
![]() 低エンドトキシン:<1.0 EU/µg
低エンドトキシン:<1.0 EU/µg
![]() AvitagTMで標識されたビオチン化Fc受容体タンパク質を提供可能:ラベル化効率が高く、標識部位が特異的で明確であるので、医薬品開発とプロセス最適化のための、ストレプトアビジンとの結合に基づくELISA / SPR / BLI検出法に適しています。
AvitagTMで標識されたビオチン化Fc受容体タンパク質を提供可能:ラベル化効率が高く、標識部位が特異的で明確であるので、医薬品開発とプロセス最適化のための、ストレプトアビジンとの結合に基づくELISA / SPR / BLI検出法に適しています。
![]() 親和性はSPR & BLIによって確認されている:生物活性が保証できます。またプロトコルを無償で提供しております。
親和性はSPR & BLIによって確認されている:生物活性が保証できます。またプロトコルを無償で提供しております。
![]() 安定性:ロット間の一貫性を確保するための厳格な品質管理が行われています。
安定性:ロット間の一貫性を確保するための厳格な品質管理が行われています。
| 分子名 | 製品番号 | ホスト | 詳細 | 構造 |
|---|
Authors: Jones EA, Waldmann TA.
Authors:Derry C. Roopenian, Shreeram Akilesh.
Authors:Imke Rudnik-Jansen, Kenneth A. Howard.
Authors: Karissa L. Gable, Jeffrey T. Guptill.
This web search service is supported by Google Inc.








