 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Protéines Fc IgG - Contrôle isotypique idéal pour le développement de médicaments structurés par IgG

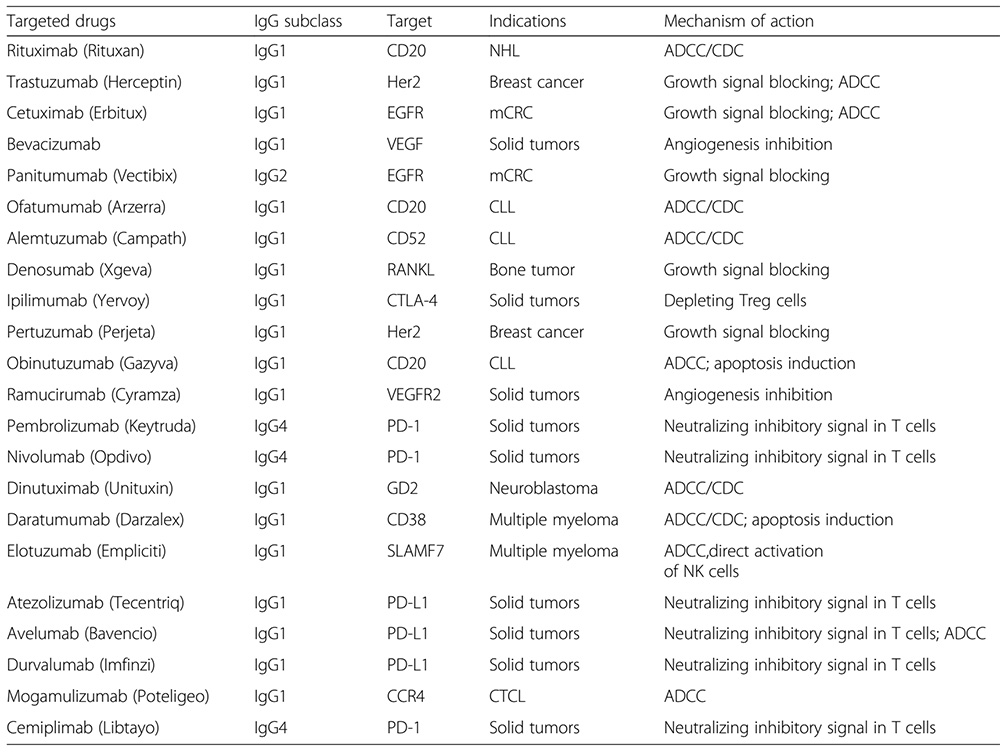
Les anticorps d’immunoglobulines de type G (IgG) ont suscité une grande attention dans l'industrie pharmaceutique en raison de leur haute spécificité et de leur pharmacocinétique supérieure depuis la fin des années 1990, notamment après l'approbation inaugurale du rituximab, premier médicament anticorps anti-tumoral, en 1997. Aujourd'hui, les anticorps IgG sont utilisés avec succès dans le traitement du cancer et des maladies auto-immunes. Les fonctions effectrices médiées par les Fc (ADCC, ADCP, CDC) jouent un rôle important dans les effets thérapeutiques parmi les mécanismes qui permettent aux différents anticorps IgG d’exercer leurs effets thérapeutiques.
Il existe quatre sous-classes distinctes d'IgG humain avec des concentrations décroissantes, à savoir IgG1, IgG2, IgG3 et IgG4 (environ 61 %, 32 %, 4 % et 3 %). Bien que toutes les sous-classes soient identiques à plus de 90 % au niveau des acides aminés et présentent des structures spatiales similaires. Elles sont hautement conservées en termes de longueur des régions charnières, du nombre de liaisons disulfure et de la fonction d'effet Fc. Ces régions sont impliquées dans la liaison aux récepteurs Ig-FC (FcγR) et au C1q. Par conséquent, les différentes sous-classes ont des fonctions effectrices différentes, tant en termes de déclenchement des cellules exprimant les FcγR, entraînant une phagocytose (ADCP) ou une cytotoxicité à médiation cellulaire dépendant des anticorps (ADCC), que d'activation du complément (CDC).
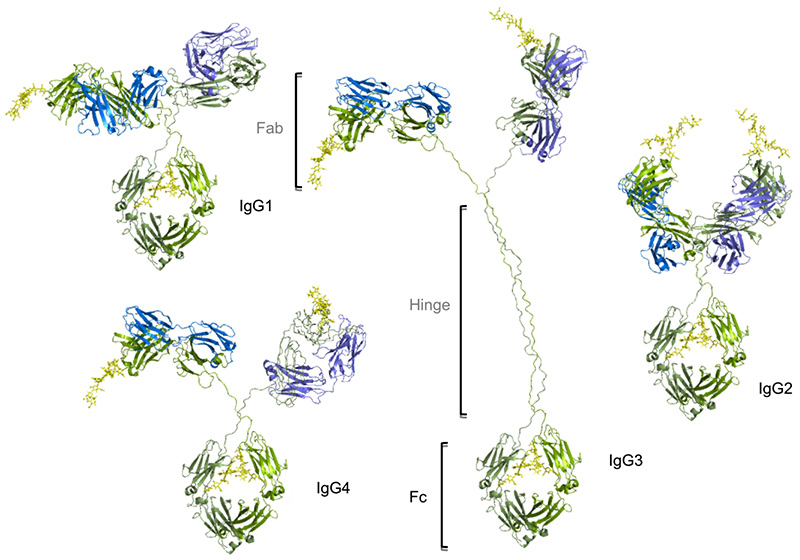
L'IgG est la sous-classe au plus fort potentiel dans l'immunothérapie tumorale. Outre l’IgG1 humain, le Fcγ de souris peut également se lier efficacement, des effets significatifs peuvent également être observés dans des modèles in vivo. La demi-vie de l’IgG1 dans l'organisme est relativement longue. De plus, d'un point de vue industriel, l'IgG1 peut être fortement exprimé et peut être purifié par la protéine A, ce qui le rend très économique et stable. Par conséquent, l'IgG1 est devenu le sous-type d'IgG le plus couramment utilisé.
L’IgG2 est principalement utilisée pour neutraliser les antigènes ou bloquer la liaison des ligands des récepteurs. L'effet ADCC est très faible. Bien que la liaison au C1q soit relativement faible, elle peut néanmoins déclencher l'effet CDC lorsque la solubilité de l'antigène ou de l'anticorps est élevée. En même temps, l'IgG2 est le seul sous-type qui peut se lier au FcγRIIa (CD32a). Au début, seuls les anticorps ciblant l'EGFR étaient commercialisés à partir du sous-type IgG2. Avec l'essor de la recherche sur les points de contrôle immunitaires, de plus en plus de médicaments du sous-type IgG2 sont entrés en clinique et sont sur le marché.
![]() Exprimés par cellules HEK293 : qui réalisent la glycosylation post-translationnelle et d'autres modifications et corrigent le repliement des protéines.
Exprimés par cellules HEK293 : qui réalisent la glycosylation post-translationnelle et d'autres modifications et corrigent le repliement des protéines.
Fc IgG1 humain, IgG2 Fc, IgG3 Fc, IgG4 Fc | |
Fc IgG1 de souris, IgG2a Fc, IgG2b Fc | |
Fc IgG2b de lama, IgG Fc de lapin |
![]() Diverss Tags : Tag free, Avitag™, His Tag, gD Tag, Flag Tag, Avitag™ et His Tag
Diverss Tags : Tag free, Avitag™, His Tag, gD Tag, Flag Tag, Avitag™ et His Tag
![]() Faible taux d'endotoxine : Moins de 1,0 EU/μg par la méthode LAL
Faible taux d'endotoxine : Moins de 1,0 EU/μg par la méthode LAL
plus de 95%, vérifié par SDS-PAGE | |
plus de 90%, vérifié par SEC-MALS |
![]() Haute bioactivité : vérifiée par ELISA et RPS avec des protocoles gratuits.
Haute bioactivité : vérifiée par ELISA et RPS avec des protocoles gratuits.
| Molécule | Cat. N° | Espèces | Description du Produit | Pré-commande Commande |
|---|---|---|---|---|
| IgG1 Fc | FCC-H5214 | Human | Human IgG1 Fc Protein, Tag Free (MALS verified) | |
| IgG1 Fc | IG1-H8213 | Human | Biotinylated Human IgG1 Fc protein, Avitag™ (MALS verified) | |
| IgG1 Fc | IG1-H5225 | Human | Human IgG1 Fc Protein, His Tag (MALS verified) | |
| IgG1 Fc | IG1-H52C9 | Human | Human IgG1 Fc Protein, Flag Tag (MALS verified) | |
| IgG1 Fc | IG1-H52G6 | Human | Human IgG1 Fc Protein, gD Tag (MALS verified) | |
| IgG2 Fc | IG2-H5206 | Human | Human IgG2 Fc Protein, Tag Free (MALS & SPR verified) | |
| IgG3 Fc | IG3-H5200 | Human | Human IgG3 Fc Protein, Tag Free (MALS & SPR verified) | |
| IgG4 Fc | IG4-H5205 | Human | Human IgG4 Fc Protein, Tag Free (MALS & SPR verified) | |
| IgG1 Fc | IG1-M5208 | Mouse | Mouse IgG1 Fc Protein, Tag Free (HPLC verified) | |
| IgG1 Fc | IG1-M8211 | Mouse | Biotinylated Mouse IgG1 Fc protein, Avitag™ (MALS verified) | |
| IgG2a Fc | IGA-M5207 | Mouse | Mouse IgG2a Fc Protein, Tag Free (MALS verified) | |
| IgG2a Fc | IGA-M8210 | Mouse | Biotinylated Mouse IgG2a Fc Protein, Avitag™ (MALS verified) | |
| IgG2b Fc | IGB-M5203 | Mouse | Mouse IgG2b Fc Protein, Tag Free (MALS verified) | |
| IgG2b Fc | IGB-L5204 | Llama | Llama IgG2b Fc Protein, Tag Free (MALS verified) | |
| IgG Fc | IGG-R5203 | Rabbit | Rabbit IgG Fc Protein, Tag Free (MALS verified) |
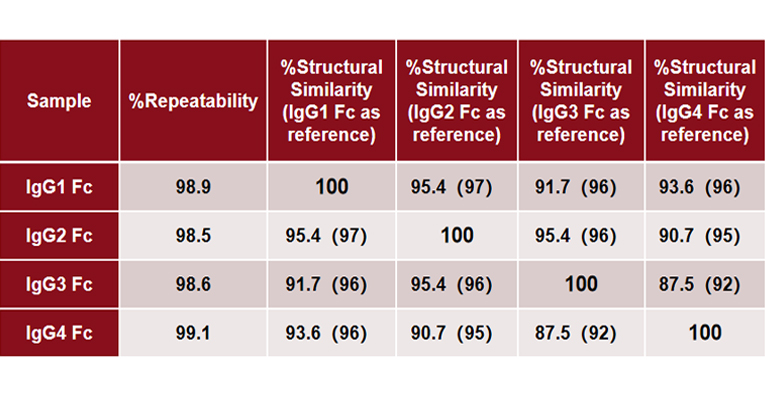
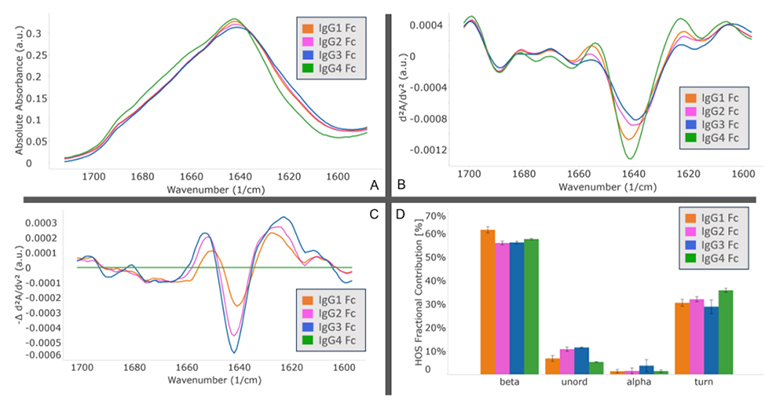
MMS analysis showed that different IgG Fc subclasses exhibit distinct secondary structures. Specifically, IgG1 and IgG2 exhibit the highest degree of structural similarity, while IgG3 and IgG4 show the greatest structural difference.
Explore the In-depth Secondary Structure Analysis of IgG Fc
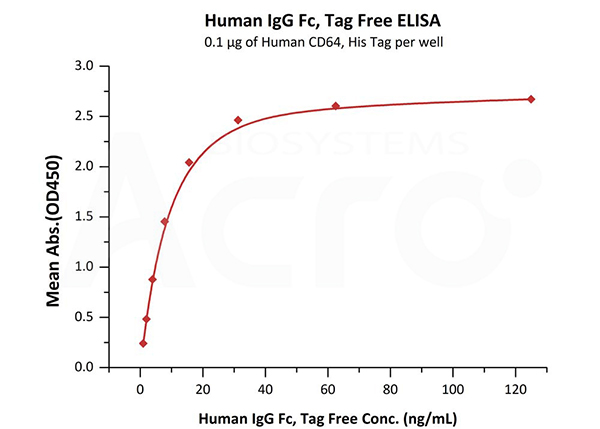
Immobilized Human CD64, His Tag (Cat. No. FCA-H52H1) at 1 μg/mL (100 μL/well) can bind Human IgG Fc, Tag Free (Cat. No. FCC-H5214) with a linear range of 1-16 ng/mL.
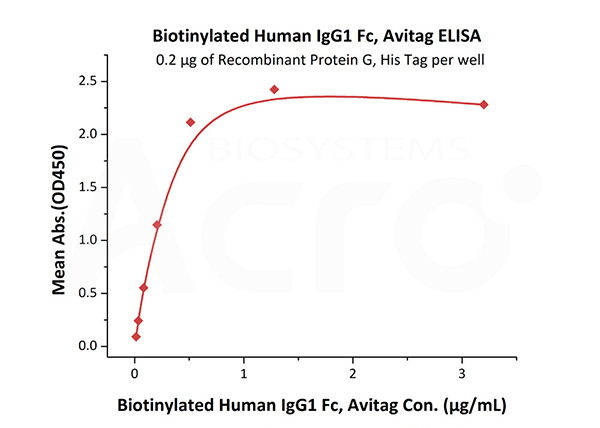
Immobilized Recombinant Protein G, His Tag (Cat. No. RPG-S3140) at 2 μg/mL (100 μL/well) can bind Biotinylated Human IgG1 Fc, Avitag (Cat. No. IG1-H8213) with a linear range of 0.013-0.512 μg/mL.
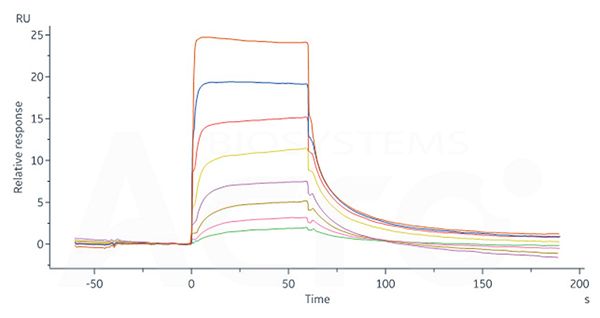
Human FCGRT&B2M Heterodimer Protein, His Tag (Cat. No. FCN-H52W7) captured on CM5 Chip via anti-His antibody can bind Human IgG1 Fc, Tag Free (Cat. No. FCC-H5214) with an affinity constant of 0.957 μM as determined in SPR assay (Biacore 8K).
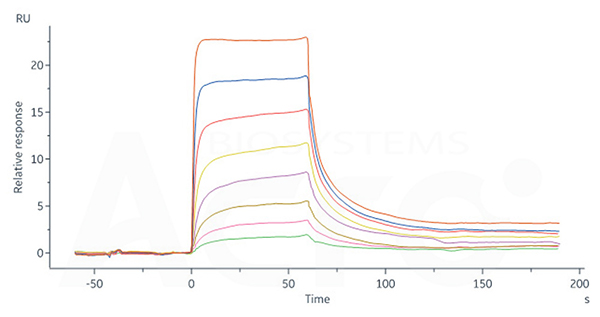
Human FCGRT&B2M Heterodimer Protein, His Tag (Cat. No. FCN-H52W7) captured on CM5 Chip via anti-His antibody can bind Human IgG4 Fc, Tag Free (Cat. No. IG4-H5205) with an affinity constant of 0.715 μM as determined in SPR assay (Biacore 8K).
Mouse IgG2a Fc protein is used as an isotype control to verify the specific binding of Mouse IgG2a CD3 monoclonal antibody (Clone: OKT3) to Human CD3 protein.
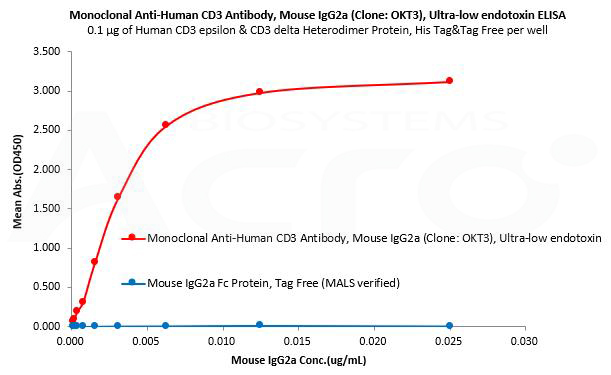
Human CD3 epsilon & CD3 delta Heterodimer Protein, His Tag&Tag Free (MALS verified) (Cat. No. CDD-H52W1) can bind Monoclonal Anti-Human CD3 Antibody, Mouse IgG2a (Clone: OKT3), Ultra-low endotoxin (Cat. No. CDE-M120a) with a linear range of 0.2-3 ng/mL and cannot bind Mouse IgG2a Fc Protein, Tag Free (MALS verified) (Cat. No. IGA-M5207).
Le Fc IgG1 humain est utilisé comme contrôle isotypique pour vérifier la liaison spécifique de l'anti-BCMA×CD3 scFv- Tag Fc IgG1 humain à la protéine CD3 humain.
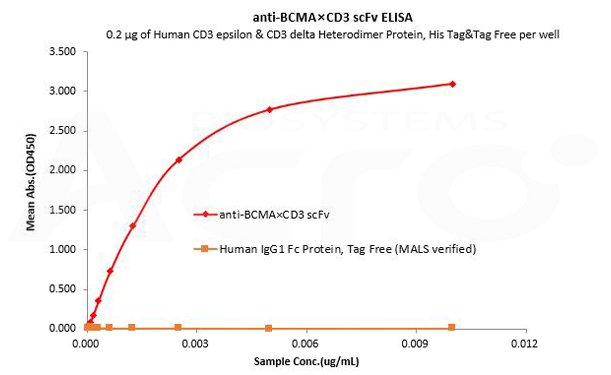
Human CD3 epsilon & CD3 delta Heterodimer Protein, His Tag&Tag Free (MALS verified) (Cat. No. CDD-H52W1) can bind anti-BCMA×CD3 scFv- Human IgG1 Fc Tag with a linear range of 0.08-3 ng/mL and cannot bind Human IgG1 Fc Protein, Tag Free (MALS verified) (Cat. No. FCC-H5214).
Le Fc IgG1 humain est utilisé comme contrôle isotypique pour vérifier la liaison spécifique de l'anti-BCMA×CD3 scFv- Tag Fc IgG1 humain à la protéine BCMA humain.
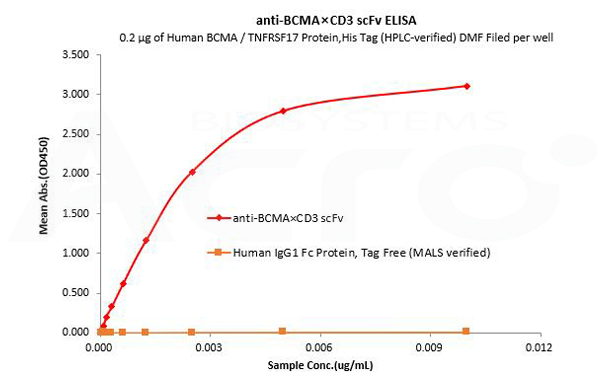
Human BCMA / TNFRSF17 Protein,His Tag (HPLC-verified) DMF Filed (Cat. No. BCA-H522y) can bind anti-BCMA×CD3 scFv- Human IgG1 Fc Tag with a linear range of 0.08-3 ng/mL and cannot bind Human IgG1 Fc Protein, Tag Free (MALS verified) (Cat. No. FCC-H5214).
>>Programmation de la demi-vie et des effets anti-tumoraux du Nanobody
>>Augmenter ou diminuer: Les deux stratégies thérapeutiques via le mécanisme médié par les FcRn
Authors:Hayes JM, Wormald MR , Rudd PM, Davey GP
Authors:Yu et al.
Authors:Ditza Levin et al.
This web search service is supported by Google Inc.
