Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>






























 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions

細胞・遺伝子治療 (CGT) 製品の製造プロセスで使用する原材料および試薬の品質は、最終的な製品品質と治療上の安全性を決定する上で極めて重要な役割を果たします。これは、細菌、真菌、マイコプラズマ、ウイルスなどの汚染物が原材料、細胞基質、製造製品に不用意に混入する外因性汚染に対し保護手段を講じる上で特に重要です。一般に、治験依頼者は、滅菌の実施や微生物やウイルスによる汚染がないことを保証するための無菌検査の実施など、材料および試薬の適切な品質管理を確保して、被験者や患者に対する不当なリスクを軽減する必要があります。CGT 製品の製造に使用する原材料の厳格な品質管理は、CGT 最終製品に対する外因性因子による汚染リスクを低減し、CGT 製品の安全性および有効性を確保するために必要な措置です。
発売される治療薬の安全性を確保するために、世界中の規制当局は、CGT 製品の製造に使用する原材料の安全性に関する当該要件を定めています。特に、FDA では、CGT 製品の製造に、容易に入手・使用可能な最高品質の原材料と試薬を使用することを推奨しています。これらの原材料および試薬は、多くの場合、「GMP Grade」のラベルが付いているか、細胞療法製品の製造用の表示があります。主要な規制文書には以下のものがあります。
(1) 『Content and Review of Chemistry, Manufacturing, and Controls (CMC) Information for Human Somatic Cell Therapy Investigational New Drug Applications (ヒト体細胞治療の治験用新薬許可申請に関する化学、製造および品質管理 (CMC) 情報の内容および審査)』FDA、2008 年 4 月。
(2) 米国薬局方<1043>『Ancillary Materials for Cell, Gene, and Tissue-Engineered Products (細胞、遺伝子および組織工学製品の製造関連物質)』。
(3) EP 5.2.12『Raw Materials of Biological Origin for the Production of Cell and Gene Therapy Medicinal Products (細胞・遺伝子治療製品の製造に使用する生物由来の原材料)』。
これら 3 報の規制関連文書は、いずれも原材料の安全性に言及し、安全性の重要性を強調しています。
当社の GMP Grade製品は、製造および品質管理プロセス全体を通して外因性因子による汚染の制御を含む安全性を総合的に考慮して設計、開発されています。その重要な点は以下のとおりです。
1. 製品の製造に使用する細胞株は、文献による裏付けが十分にあり、供給源である ECACC まで追跡可能です。
2. 生産宿主細胞の HEK293 に対し、順化および樹立後に包括的な検査 (26 項目) を実施します。
検査は、以下の規制に従い、国際的に有名な第三者検査機関によって実施されます。
• ICH Q5『パート 3: 細胞株適格性試験: ウイルス試験』。
• FDA『Points to Consider in the Characterization of Cell Lines Used to Produce Biologicals (生物学的製剤を生産するために用いられる細胞株の適格性試験の考慮事項)』(1993 年)、特に「V.QUALITY CONTROL TESTING (V. 品質管理試験)」セクション。
• FDA『Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications (感染症適応のウイルスワクチンの製造に用いる細胞基質およびその他の生物学的材料の特性評価および適格性評価試験)』(2010 年)。
3. 遺伝子操作を受けた細胞には、細胞バンクの構築後にさらなる試験を実施します。検査は、国内の有名な第三者検査機関によって実施され、特に、無菌性試験、マイコプラズマ試験、細胞形態学的試験、in vitro でのさまざまな指標細胞接種法、レトロウイルスおよび外因性ウイルスの検出試験などが含まれます。
4. 上流の細胞培養段階では、明確に定義された培地である合成培地 (CDM) を使用します。上流の製造プロセスで使用するすべての原材料は、無血清 (SF) および動物由来成分フリー (AOF) です。細胞の回収および増殖を、クラス C 清浄区域の生物学的安全キャビネット (BSC) で実施します。リアクター製造の段階では、シングルユースの閉鎖系と無菌溶接技術を利用しています。混入汚染リスクや相互汚染リスクを最小限に抑えるために、さまざまな製造段階が隔離されています。
5. 下流の精製プロセスの設計時に、低 pH 処理やナノ濾過などのウイルス除去 / 不活化ステップを導入しています。重要なステップとして、ウイルス除去プロセスのバリデーションも実施します。精製プロセスでは、プロジェクト専用の分離カラムとクロマトグラフィー担体を利用することで、異なる製造段階の間の相互汚染リスクを防止します。
以下の規制にはウイルスの安全性に関する指針が示されています。
• 『ヒトまたは動物細胞株を用いて製造されるバイオテクノロジー応用医薬品等のウイルス安全性評価』1999 年、日米 EU 医薬品規制調和国際会議 (ICH) Q5A (R1)。
• 『Guideline on Virus Safety Evaluation of Biotechnological Investigational Medicinal Products (バイオテクノロジー応用治験薬のウイルス安全性評価に関するガイドライン)』EMEA/CHMP/BWP/398498/2005 欧州医薬品庁 (EMA)、2009 年。
• 『Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal (ヒトまたは動物細胞株を用いて製造されるバイオテクノロジー応用医薬品等のウイルス安全性評価)』米国薬局方、総則:<1050>。
6. 製剤の製造は、厳格なGrade B+A の製造環境で実施されます。滅菌濾過後、全自動装置とシングルユース滅菌充填システムを使用して半製品を処理します。無菌コンポーネントの組み立て、充填、打栓、自動送込み・送出し、凍結乾燥などの作業を、Grade B+A のクリーンルーム環境 (PMS 連続環境モニタリングシステムによる監視) で実施します。凍結乾燥後、バイアルをGrade C+A 環境で密封します。最終製品は、手作業による検査、ラベル貼付などの作業を受け、品質検査に合格した後、出荷されます。
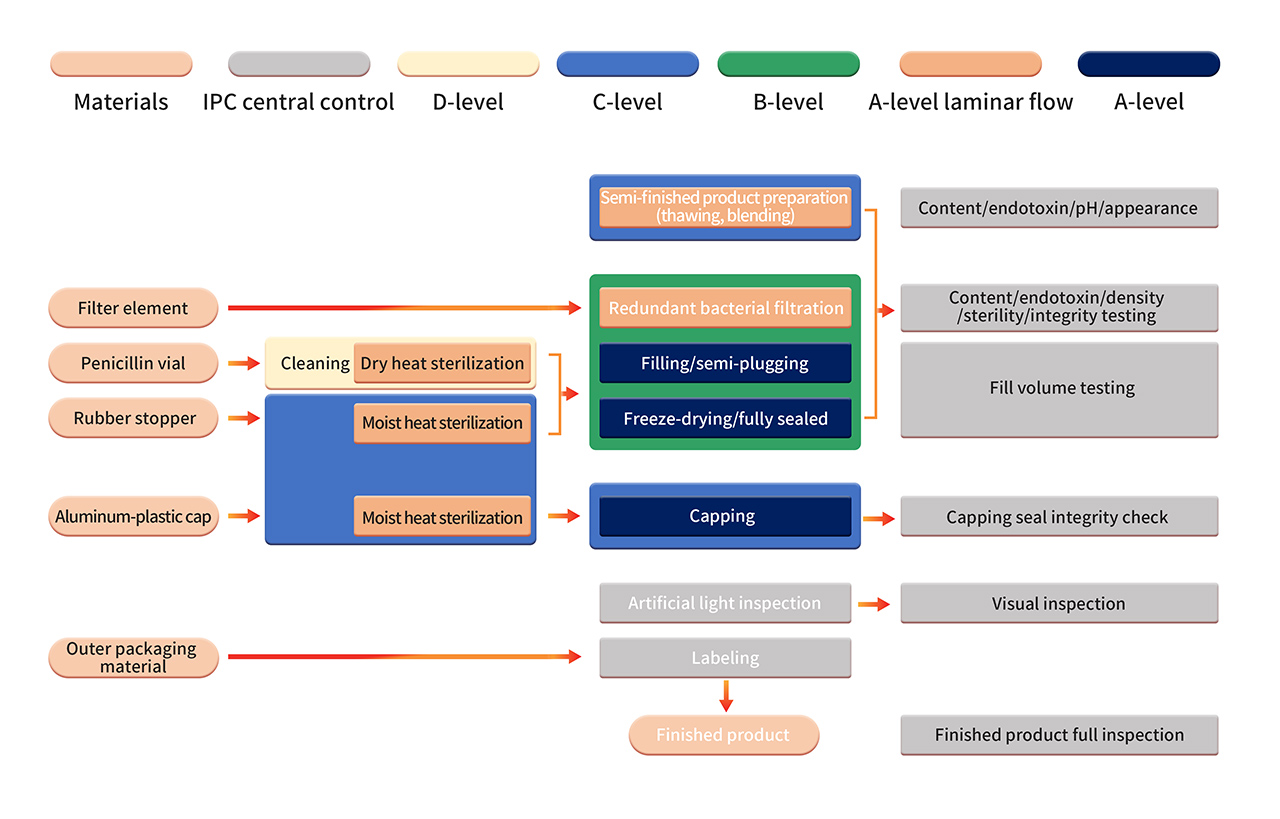
7. 厳格な無菌プロセスのバリデーションには、APS (培地シミュレーション容器) 内での無菌栄養培地や製品代用品の使用を含む、無菌プロセス管理による定期的な確認が含まれます。APS では、プロセス材料の滅菌および洗浄から容器の密封までに行われるすべての無菌操作を評価します。通常の製造条件およびワーストケース条件下で、さまざまな既知の無菌操作と介入を検討します。
参考規制:
• EU GMP Annex 1。
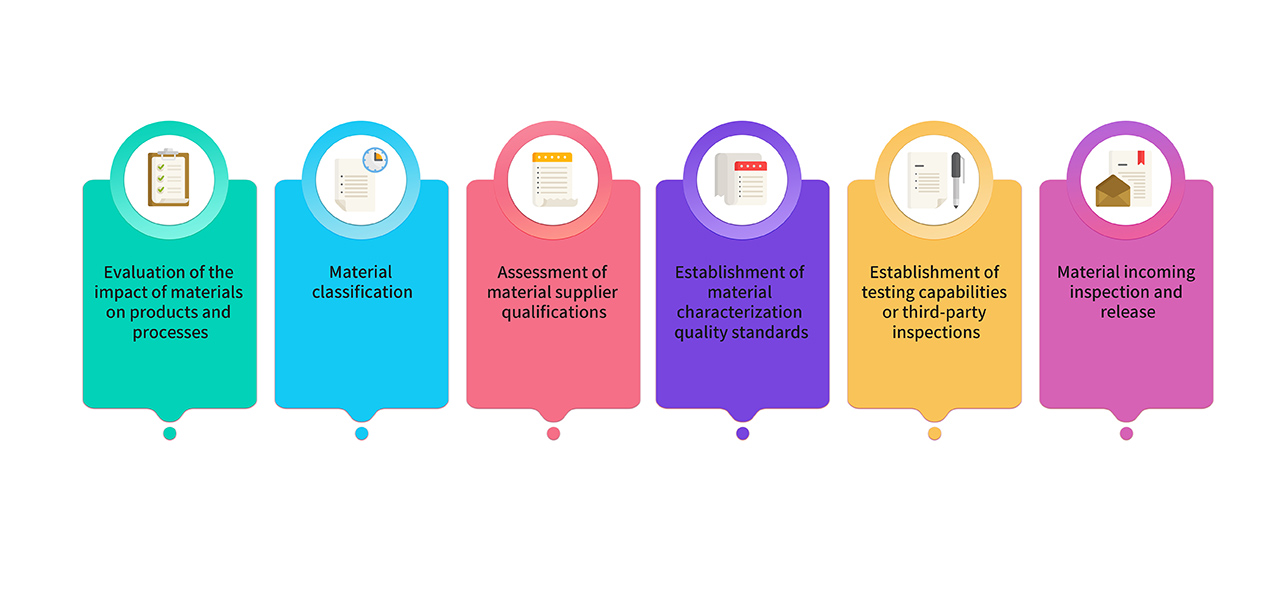
8. 製造に使用する原材料および包装材料を、医薬品Gradeの原材料から選択します。GMP 製品の製造に使用する原材料には、研究、製造、品質の各チームによる共同評価と分類を実施します。重要な材料は関連する規制および薬局方の要件を満たし、その品質基準は重要な特性評価解析を通じて確立されます。原材料管理プロセスは以下のとおりです。
9. 当社の GMP Grade製品は、医薬品Gradeの製造工場で生産されるだけでなく、国内および国際的な関連の CGT 規制に従って設計および管理されています。GMP Gradeの IL-15 を例に挙げると、当社の最終製品の品質管理出荷判定には以下の内容が含まれます。
• SDS-PAGE で 95% を上回る
• エンドトキシン濃度が 10 EU/mg 未満
• 宿主細胞由来残存 DNA 含有量が 0.02 ng/μg 未満
• 宿主細胞由来残存タンパク質含有量が 0.5 ng/μg 未満
• 生物活性が 0.8 x 10 7 IU/mg を上回る (規格値として WHO ヒト IL-15 (NIBSC コード: 90/530) を参照)
• 微生物試験
• マイコプラズマ試験
• in vitro ウイルス力価試験
• ロット間の一貫性
• 包括的な安定性データによる裏付け (加速安定性、凍結融解安定性、長期安定性、輸送安定性確認)
ACROBiosystems では、開発、製造、品質検査、品質システムの全プロセスを通じて潜在的な外因性因子を厳密に管理し、製品の安全性を確保しています。当社は、細胞・遺伝子治療で臨床使用するための高品質試薬を開発し、医薬品の製造基準とより厳格な品質管理基準および出荷判定試験基準を組み合わせることで、より安全性の高い GMP Grade製品をお客様に提供できるよう尽力しています。
GMP 製品品質を詳細に解説した特別シリーズのトレーラーが登場!
• 細胞・遺伝子治療に重要な原材料の製造における外部汚染物質の制御。
• CGT に不可欠な原材料を製造するための無菌的保護戦略
• CGT における重要な原材料の品質管理システム
• CGT における重要な原材料のグローバル サプライ チェーン セキュリティ システム
• CGT の重要な原材料が米国規制要件を適切に満たす方法
• ...
This web search service is supported by Google Inc.












