Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>






























 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions

세포 유전자 치료제(Cell and Gene Therapy, CGT) 제조 공정에 사용되는 물질 및 시약의 품질은 최종 치료제 품질과 치료 안전성을 결정하는 데 중요한 역할을 합니다. 특히, 박테리아, 곰팡이, 미코플라스마, 바이러스 등의 오염물질이 의도치 않게 원료 물질, 세포 기질 및 제조 제품에 유입되는 것을 포함한 외인성 오염으로부터 보호하는 것이 중요합니다. 일반적으로 치료제 개발자는 미생물 및 바이러스 오염 물질 유무를 확인하기 위해 멸균 또는 무균 시험을 실시하는 등, 시험대상자나 환자의 위험을 방지하기 위해 원료 및 시약의 적절한 품질 관리를 보장해야 합니다. CGT 제조에 사용되는 원료 물질에 대한 엄격한 품질 관리는 CGT 최종 제품의 외인성 인자 오염의 위험을 줄이고 CGT 제품의 안전성과 유효성을 보장하기 위한 필수 조치입니다.
향후 출시될 치료제의 안전성을 보장하기 위해 전 세계 규제 기관은 CGT 제조에 사용되는 원료 물질의 안전성에 대한 관련 요건을 마련했습니다. 특히 FDA는 CGT 제조를 위해 쉽게 구할 수 있고 사용 가능한 원료와 최고 품질의 시약을 사용할 것을 권장합니다. 이러한 원료와 시약은 'GMP 등급'이라고 라벨에 표시 기재되거나 세포 치료제 제조용이라고 명시되는 경우가 많습니다. 주요 규제 문서는 다음과 같습니다.
(1) '인간 체세포 치료제 임상시험용 신약 허가 신청을 위한 화학, 제조 및 관리 정보의 내용 및 검토 (Content and Review of Chemistry, Manufacturing, and Controls (CMC) Information for Human Somatic Cell Therapy Investigational New Drug Applications, 2008년 4월 FDA에서 발행) '.
(2) USP<1043>'세포, 유전자 및 조직 공학 제품용 보조 물질(Ancillary Materials for Cell, Gene, and Tissue-Engineered Products)'.
(3) EP 5.2.12 '세포 및 유전자 치료 의약품 제조용 생체 유래 원료 물질(Raw Materials of Biological Origin for the Production of Cell and Gene Therapy Medicinal Products)'.
이 세 가지 규제 문서 모두 원료 물질의 안전성을 언급하며 안전의 중요성을 강조했습니다.
당사의 GMP 등급 제품은 안전성을 종합적으로 고려하여 설계 및 개발되었으며, 여기에는 전체 제조 및 품질 관리 공정에 걸친 외인성 인자 오염의 통제에 관한 고려도 포함되었습니다. 주요 사항은 다음과 같습니다.
1. 제조에 사용된 세포주에 관한 사항은 문서화되어 있으며 출처인 ECACC를 확인할 수 있습니다.
2. 제조용 숙주 세포인 HEK293은 순화(domestication) 및 확립(establishment) 후 종합적인 시험(26개 항목)을 거칩니다.
시험은 다음 규정에 따라 국제적으로 유명한 제3자 시험 기관에서 실시합니다.
• ICH Q5 파트 3: 세포주 특성 분석: 바이러스 시험(ICH Q5 Part III: Cell Line Characterization: viral testing).
• FDA의 '생물학적 제제 제조에 사용되는 세포주의 특성 분석 시 고려해야 할 사항(Points to Consider in the Characterization of Cell Lines Used to Produce Biologicals)'(1993), 특히 '5. 품질 관리 시험(V. QUALITY CONTROL TESTING)' 섹션 참조.
• FDA의 '감염성 질환 적응증에 대한 바이러스 백신 제조에 사용되는 세포 기질 및 기타 생물학적 물질의 특성 분석 및 검증(Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications)'(2010).
3. 조작된 세포는 세포 은행을 구축한 후 추가 시험을 거칩니다. 국내 유명 제3자 시험 기관에서 실시하는 이 시험에는 무균 시험, 미코플라스마 시험, 세포 형태 시험, 생체 외(in vitro) 다양한 지표 세포 접종법 시험, 레트로바이러스 및 외인성 바이러스 검출 시험 등이 포함됩니다.
4. 업스트림 세포 배양 단계에서는 화학적으로 정의된 배지(chemically defined medium, CDM)를 사용합니다. 업스트림 제조 공정에 사용되는 모든 원료는 무혈청(serum-free, SF) 및 동물 유래 성분 비포함(animal-origin-free, AOF) 원료입니다. 세포 회수 및 증폭은 C등급 청정 구역 생물안전 작업대(BSC)에서 수행됩니다. 반응기 제조 단계에서는 일회용 폐쇄형 시스템과 무균 융착 기술을 활용합니다. 오염 및 교차 오염의 위험을 최소화하기 위해 여러 제조 단계가 분리되어 있습니다.
5. 다운스트림 정제 공정 설계 시, 낮은 pH 처리 및 나노 여과와 같은 바이러스 제거/비활성화 단계를 도입합니다. 중요한 단계에 대한 (공정 중) 바이러스 제거 공정 밸리데이션 또한 수행됩니다. 정제 공정에서는 프로젝트별 분리 컬럼과 크로마토그래피 매질을 사용하여 서로 다른 제조 단계 간의 교차 오염 위험을 방지합니다.
다음 규정에 바이러스 안전성에 대한 지침이 제시되어 있습니다.
• 인간 또는 동물 유래 세포주에서 유래한 생명공학 제품의 바이러스 안전성 평가(Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin). 1999. 국제의약품규제조화회의(International Conference on Harmonization, ICH)(ICH)Q5A(R1).
• 생명공학 연구용 의약품의 바이러스 안전성 평가에 관한 가이드라인(Guideline on Virus Safety Evaluation of Biotechnological Investigational Medicinal Products). EMEA / CHMP / BWP / 398498 / 2005. 유럽 의약품청(European Medicines Agency, EMA). 2009.
• 인간 또는 동물의 세포주에서 유래한 생명공학 제품의 바이러스 안전성 평가(Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal). USP 일반 챕터(General Chapters):<1050>.
6. 제제 제조는 엄격한 B+A 등급 제조 환경에서 이루어집니다. 멸균 여과 후 반제품은 완전 자동화된 장비와 일회용 멸균 충전 시스템을 사용한 처리를 거칩니다. 무균 구성 요소 조립, 충전, 타전, 자동 주입 및 배출, 동결건조 등의 작업은 B+A 등급의 청정한 환경에서 수행됩니다(PMS 연속 환경 모니터링 시스템을 사용하여 모니터링됨). 동결건조 후 바이알은 C+A 등급 환경에서 밀봉됩니다. 완제품은 품질 시험을 통과한 후 출하되기 전에 수동 검사, 라벨링 등의 작업을 거칩니다.
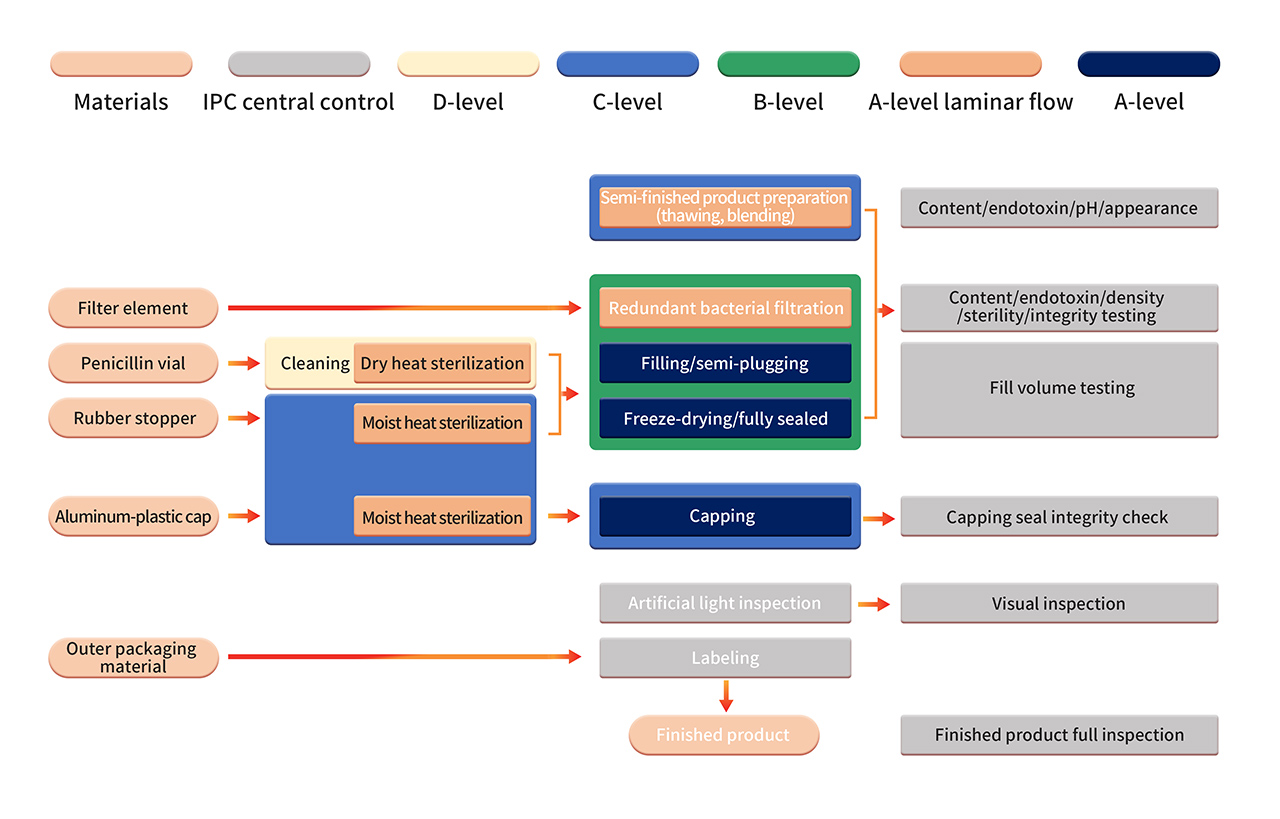
7. 엄격한 무균 공정 밸리데이션에는 무균 영양 배지 및/또는 APS(배지 시뮬레이션 용기)에서의 제품 대체물 사용을 포함한 무균 공정 제어에 대한 정기적인 확인이 포함됩니다. APS를 통해 공정 원료의 멸균 및 세척부터 용기 밀봉에 이르기까지 수행되는 모든 무균 작업을 평가합니다. 정상적인 제조 조건 및 최악 조건하에서 이미 알려져 있는 다양한 무균 작업 및 개입이 고려됩니다.
참조 규정:
• EU GMP 부록 1.
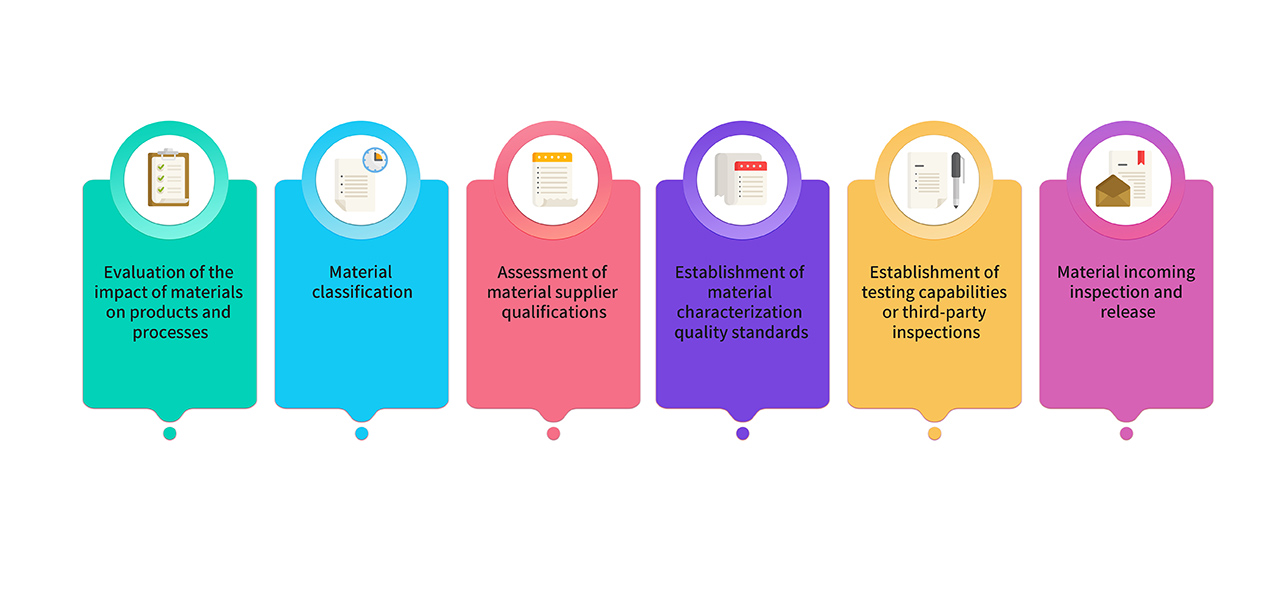
8. 제조에 사용되는 원료 물질과 포장재는 의약품 등급의 원료를 엄선하여 사용합니다. GMP 제품 제조에 사용되는 원료의 경우 연구, 제조, 품질 팀이 공동으로 평가 및 분류를 진행합니다. 주요 원료는 관련 규정 및 약전의 요건을 준수하며, 중요 특성 분석을 통해 품질 표준이 수립되어 있습니다. 원료 관리 공정은 다음과 같습니다.
9. 당사의 GMP 등급 제품은 의약품 등급의 제조 공장에서 제조될 뿐만 아니라 국제 CGT 관련 규정에 따라 설계 및 관리됩니다. GMP 등급 IL-15를 예로 들면, 당사의 최종 제품 품질 관리 릴리스 시험에는 다음과 같은 시험이 포함됩니다.
• SDS-PAGE>95%
• 내독소 수치 10 EU/mg 미만
• 잔류 숙주 세포 DNA 함량 0.02ng/μg 미만
• 잔류 숙주 세포 단백질 함량 0.5ng/ug 미만
• 생물학적 활성 >0.8 x 107 IU/mg (참조 표준: WHO 인간 IL-15 (NIBSC 코드: 90/530))
• 미생물 시험
• 미코플라스마 시험
• 생체 외 바이러스 분석
• 배치 간 일관성 유지 시험
• 포괄적인 안정성 데이터를 뒷받침하기 위한 시험(가속, 동결-해동, 장기, 배송 안정성 검증)
ACROBiosystems 는 개발, 제조, 품질 시험, 품질 시스템에 걸친 전체 공정에서 잠재적인 외인성 인자를 엄격하게 통제하여 제품의 안전성을 보장합니다. 당사는 세포 및 유전자 치료에 임상적으로 사용되는 고품질 시약을 개발하고 의약품 제조 표준에 더욱 엄격한 품질 관리 및 출하 시험 표준을 적용하여 고객에게 더욱 안전한 GMP 등급 제품을 제공하기 위해 최선을 다하고 있습니다!
GMP 제품 품질 심층 분석 시리즈를 확인해 보세요!
• GMP제품 품질의 심층 해석에 관한 특별한 주제--토픽
• CGT 중요 원료 제조를 위한 무균 관리 전략
• CGT 중요 원료의 품질 관리 시스템
• CGT의 중요 원료의 글로벌 공급망 보안 시스템
• CGT의 중요 원료에 대한 미국 규제 요건을 더 잘 충족하는 방법
• ...
This web search service is supported by Google Inc.













